Isotoper: 13c
Isotopomerer
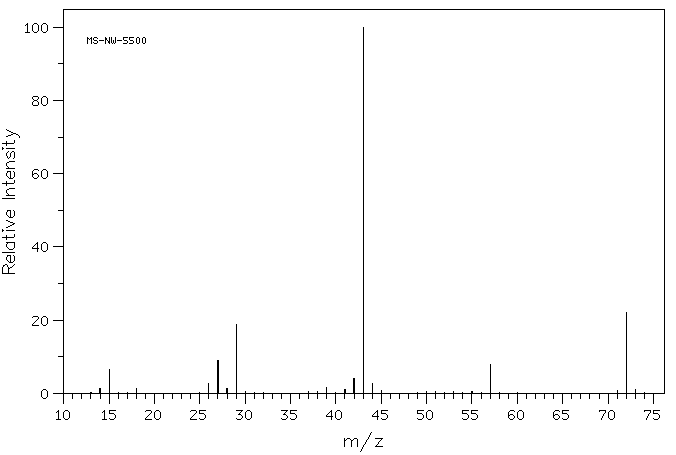
hvis du ser nøye på massespektret av en organisk forbindelse, 2-butanon, ser du en linje på m / z 72, som tilsvarer 4 karboner, en oksygen og 8 hydrogen.
- vanligvis brukes hele tall for molekylvekt i massespektrometri.atommassene i periodesystemet, ut til 4 desimaler, er gjennomsnittsmassene, inkludert forskjellige mulige isotoper.Fordi massespektrometri undersøker individuelle molekyler, er det behov for individuelle atommasser, ikke gjennomsnittlige. Vanligvis betyr det å bruke et helt tall.
I tillegg er det en rekke andre linjer ved lavere verdier av m / z; disse tilsvarer massene av mindre stykker av de 2-butanonmolekylene som faller fra hverandre under forsøket. Vi vil ikke se for nøye på hvordan de oppstår før vi kommer til radikale reaksjoner senere i kurset. Vi vil imidlertid se på noen faktorer som gjør kationer stabile senere i dette kapitlet.
hvis du ser nøye på massespektret av 2-butanon, vil du også se en annen liten topp på m / z 73. Dette refereres Til Som m + 1-toppen (en større enn molekylær ion), og det oppstår PÅ GRUNN AV 13C. Denne forbindelsen refereres til som en isotopomer; det betyr den samme forbindelsen med en annen isotop.12C er omtrent 99% rikelig; 99% av karbonatomer har en masse på 12 amu.
sjansen for at et molekyl i en prøve inneholder ET 13c atom er relatert til antall karboner tilstede. Hvis det bare er ett karbonatom i molekylet, har det en 1% sjanse FOR Å være EN 13C. det betyr At m+1-toppen bare vil være 1/100th så høy Som M+, toppen for molekylær ion.
- m + 1-toppen fra et 13c-atom er veldig liten.
- jo flere karboner det er i et molekyl, desto større er m + 1-toppen.
- Hvis det er 10 karbonatomer i molekylet, er det en 10% sjanse for AT ET 13c-atom er tilstede. M + 1-toppen er omtrent 1 / 10th størrelsen På M + – toppen.
- Hvis det er 100 karboner i molekylet, er det en veldig god sjanse for AT ET 13c-atom er tilstede. På det tidspunktet Er m + 1-toppen faktisk mye større Enn M+. topp
Leave a Reply