Koncentration af hydrogenioner

Næste opstår spørgsmålet om, hvad der bestemmer surhedsgraden eller alkaliniteten af en opløsning.
faktisk bestemmes det af koncentrationen af hydrogenioner, procentdelen af hydrogenioner indeholdt i opløsningen.
Lad os tage vand som et eksempel.
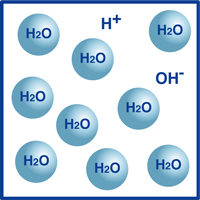
som du ved, er formlen for vand H2O. de fleste af molekylerne i vand er i den ekstremt stabile form, vi kender som H2O.
imidlertid er en meget lille procentdel af disse molekyler brudt op i hydrogenioner (H+) og hydroksidioner (OH -), som illustreret i figuren.
faktisk bestemmer denne balance mellem hydrogenioner og hydroksidioner vandets pH.
når hydrogenionerne overstiger hydroksidionerne, er opløsningen sur. Hvis det modsatte er sandt, er opløsningen alkalisk.
Hvis temperaturen ikke varierer, findes følgende forhold mellem densiteterne af hydrogenioner (H+) og hydroksidioner (OH-) med en hvilken som helst opløsning:
=kV=10-14(=fast) ved 25 liter
(kV kaldes ionproduktet af vand eller dissociationskonstant af vand.)
i rent vand eller neutral opløsning gælder følgende formel, fordi
=,
==liter(kV)=liter 10-14=10-7
Hvis du kender værdien af en eller , kan du finde værdien af den anden.
således måler vi kun og bruger det som standard for pH. på denne måde bestemmes pH af hydrogenionkoncentration.

så pH er defineret af følgende formel:
pH=-log10
koncentrationen af hydrogenioner i enhver opløsning, vi sandsynligvis vil støde på, vil variere fra 1 mol til 0,000001 mol pr. Imidlertid, løsninger med ekstremt lav brint-ionkoncentration kunne tænkes at samle en temmelig lang parade af nuller efter decimaltegnet. Den danske biokemiker S. P. L. Sørensen var den første til at bruge det pH-system, vi kender i dag, som definerer inverse tal af brint-ionkoncentration vist i fælles logaritme som pH. Det vil sige
pH=-log10
i tilfælde af en neutral opløsning,
=10-7 , som vi kalder en pH på 7.
dette betyder for eksempel, at en hydrogenionkoncentration af en opløsning med en pH på 4 er 10-4mol / l, hvilket betyder, at den indeholder 0,0001 mol hydrogenioner i en opløsning på 1 liter. På samme måde indeholder en opløsning med en pH på 5 10-5mol/l hydrogenioner, en opløsning med en pH på 6 indeholder 10-6mol/l hydrogenioner, mens opløsningen med en pH på 7 indeholder 10-7mol/l hydrogenioner. Du vil bemærke, at hvis du sammenligner opløsninger med pH på 4 og pH på 7, er forskellen i pH kun 3, men koncentrationen af hydrogenioner med en pH på 7 er 1000 gange så høj som med en pH på 4.Følgende figur viser også fordelen ved eksponenter, som kan udtrykke store variationer i værdi, der spænder over mange størrelsesordener.
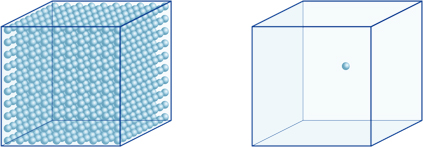
antallet af hydrogenioner i terningen til venstre (10-4mol/L) er 1.000 gange større end i den til højre (10-7mol/L); Dette svarer til en forskel på 3 i pH-værdien. (En enkelt blå kugle repræsenterer 10-7mol/L hydrogenioner.)
Næste side Hydrogen-Ion aktivitet
Leave a Reply