농도의 수소이온

음 발생의 질문을 결정하는 것이 산성 또는 알칼리성의 솔루션입니다.
실제로,그것은 수소 이온의 농도,용액에 함유 된 수소 이온의 비율에 의해 결정됩니다.
물 한 예로 들어 봅시다.
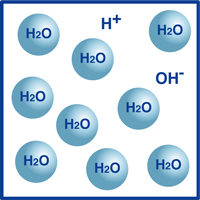
아시다시피,물 공식은 H2O 입니다.물에있는 분자의 대부분은 우리가 H2O 로 알고있는 매우 안정적인 형태입니다.
그러나,그 분자의 아주 작은 백분율은 도면에 도시 된 바와 같이 수소 이온(H+)및 수산화 이온(OH-)으로 분해되었다.
실제로,이 수소 이온과 수산화 이온의 균형은 물 pH 를 결정합니다.
수소 이온이 수산화 이온보다 많으면 용액은 산성입니다. 반대가 사실이라면 용액은 알칼리성입니다.
경우에는 온도 변하지 않는,다음 사이의 관계를 밀도의 수소이온(H+)과 수산화물이온(OH-)이 발견된 모든 솔루션:
=Kw=10-14(=고정)25℃
(Kw 물 이온 생성물 또는 물 해리 상수라고합니다.)
에서는 순수한 물이나 중립적 솔루션,다음 공식 보유하고 있기 때문에,진실
=
==√(Kw)=√10-14=10-7
경우에 당신의 가치를 알고 있거나 또는,당신을 찾을 수 있습니다 값이다.
따라서,우리는 측정만으로 그것을 사용하고 표준에 대한 pH. 이 방법으로,pH 에 의해 결정된 수소이온 농도이다.

따라서 pH 는 다음 공식에 의해 정의됩니다:
pH=-log10
농도의 수소이온에 모든 솔루션은 우리는 우리가 발생할 가능성이 있는 것 범위에서 1mol 을 0.000001mol 리터당의 솔루션입니다. 그러나 수소-이온 농도가 매우 낮은 용액은 소수점 이후에 0 의 꽤 긴 퍼레이드를 올릴 수 있습니다. 덴마크 생화학 S.P.L. 학교는 첫번째이었을 사용하여 pH 시스템 오늘날 우리가 알고 있을 정의하는 역 숫자의 수소이온 농도를 표시에서 일반적인 로그으로 pH. 즉,
ph=-log10
중성 용액의 경우
=10-7,우리는 7 의 pH 라고 부릅니다.
이 의미는,예를 들어,수소-이온의 농도는 솔루션으로 pH4 10-4mol/l 의미,담 0.0001mol 의 수소이온의 솔루션에서 1 리터. 동일한 방식으로 솔루션으로 pH of5 포 10-5mol/l 의 수소이온 솔루션으로 pH6 포 10-6mol/l 의 수소이온 동안 솔루션으로 pH7 포 10-7mol/l 의 수소이온. Ph 가 4 이고 pH 가 7 인 용액을 비교하면 pH 의 차이는 3 에 불과하지만 ph 가 7 인 수소 이온의 농도는 ph 가 4 인 경우보다 1000 배 높다는 것을 알 수 있습니다.다음 그림을 보여줍의 이점을 지수할 수 있는 익스프레스에서 큰 변화에 가치는 범위를 통해 많은 주문이의 크기.
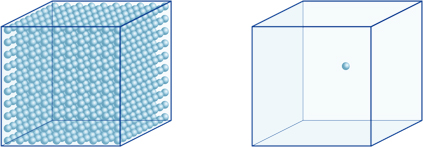
수소이온에서 큐브 왼쪽에(10-4mol/L)1000 배에서보다 더 하나의 오른쪽에(10-7mol/L);이것은 상당의 차이에서 3pH 값입니다. (단 하나 파란 공은 수소 이온의 10-7mol/L 를 대표합니다.)
다음 페이지 수소 이온 활동
Leave a Reply