Concentrazione di ioni idrogeno

Quindi sorge la domanda su cosa determina l’acidità o l’alcalinità di una soluzione.
In realtà, è determinato dalla concentrazione di ioni idrogeno, la percentuale di ioni idrogeno contenuti nella soluzione.
Prendiamo l’acqua come esempio.
Come sapete, la formula per l’acqua è H2O. La maggior parte delle molecole in acqua sono in quella forma estremamente stabile che conosciamo come H2O.
Tuttavia, una percentuale molto piccola di quelle molecole si sono suddivise in ioni idrogeno (H+) e ioni idrossido, (OH-), come illustrato nella figura.
In realtà, questo equilibrio di ioni idrogeno e ioni idrossido determina il pH dell’acqua.
Quando gli ioni idrogeno superano gli ioni idrossido, la soluzione è acida. Se il contrario è vero, la soluzione è alcalina.
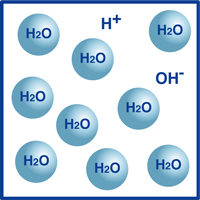
Se la temperatura non varia, la seguente relazione tra le densità di ioni idrogeno (H+) e ioni idrossido (OH-) si trova con qualsiasi soluzione:
=Kw = 10-14 (=fisso) a 25℃
(Kw è chiamato il prodotto ionico dell’acqua o costante di dissociazione dell’acqua.)
In acqua pura o soluzione neutra, la seguente formula è valida, perché
=,
==√(Kw)=√10-14=10-7
Se si conosce il valore di uno o , è possibile trovare il valore dell’altro.
Quindi, misuriamo solo e lo usiamo come standard per il pH. In questo modo, il pH è determinato dalla concentrazione di ioni idrogeno.

Quindi, il pH è definito dalla seguente formula:
pH=-log10
La concentrazione di ioni idrogeno in qualsiasi soluzione che probabilmente incontreremo andrà da 1 mol a 0,000001 mol per litro di soluzione. Tuttavia, soluzioni con concentrazione di ioni idrogeno estremamente bassa potrebbero concettualmente accumulare una lunga parata di zeri dopo il punto decimale. Il biochimico danese S. P. L. Sorensen è stato il primo ad utilizzare il sistema pH che conosciamo oggi, che definisce i numeri inversi della concentrazione di ioni idrogeno mostrati nel logaritmo comune come pH. Vale a dire,
pH=-log10
Nel caso di una soluzione neutra,
=10-7 , che chiamiamo un pH di 7.
Ciò significa, ad esempio, che una concentrazione di ioni idrogeno di una soluzione con un pH di 4 è 10-4mol / l, il che significa che contiene 0,0001 mol di ioni idrogeno in una soluzione di 1 litro. Allo stesso modo, una soluzione con un pH di 5 contiene 10-5mol/l di ioni idrogeno, una soluzione con un pH di 6 contiene 10-6mol/l di ioni idrogeno, mentre la soluzione con un pH di 7 contiene 10-7mol/l di ioni idrogeno. Noterai che se confronti soluzioni con pH di 4 e pH di 7, la differenza di pH è solo 3, ma la concentrazione di ioni idrogeno con un pH di 7 è 1000 volte più alta rispetto a un pH di 4.La figura seguente mostra anche il vantaggio degli esponenti, che possono esprimere grandi variazioni di valore che variano su molti ordini di grandezza.
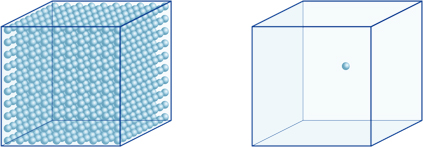
Il numero di ioni idrogeno nel cubo a sinistra (10-4mol/L) è 1.000 volte più grande di quello a destra (10-7mol / L); ciò equivale a una differenza di 3 nel valore del pH. (Una singola palla blu rappresenta 10-7mol/L di ioni idrogeno.)
Pagina successiva Attività degli ioni idrogeno
Leave a Reply