Natriumkloridi ominaisuudet / / onko natriumkloridi hyvä sinulle?
artikkelia
natriumkloridi on ioniyhdiste, jonka kemiallinen kaava on NaCl. Se on väritön kuutiokide tai hienokiteinen jauhe ja maistuu suolaiselta.
ulkonäkö on valkoinen kide, ja sen lähteenä on pääasiassa merivesi, joka on pöytäsuolan pääkomponentti. Liukenee veteen, glyseriiniin, liukenee hieman etanoliin (alkoholiin), nestemäiseen ammoniakkiin, liukenematon väkevään suolahappoon. Epäpuhdas natriumkloridi hoippuu ilmassa.
stabiilisuus on suhteellisen hyvä, ja sen vesiliuos on neutraali. Teollisesti elektrolyyttisesti tyydyttyneen natriumkloridiliuoksen menetelmää käytetään yleensä vedyn, kloorin ja kaustisen soodan (natriumhydroksidin) ja muiden kemiallisten tuotteiden (yleisesti kutsutaan kloori-alkaliteollisuudeksi) valmistamiseen.
sitä voidaan käyttää malminsuolauksessa (natriumkloridikiteiden elektrolyyttinen sulaminen aktiivimetallinatriumin tuottamiseksi), lääketieteellisesti fysiologisen suolaliuoksen määrittämiseen ja päivittäiselinkäyttöä voidaan käyttää mausteissa.
yhdisteen käyttöönotto
perustiedot
englanninkielinen nimi: natriumkloridi
englanninkielinen alias: natriumhydrokloridi; natriumkloridi
CAS-numero: 7647-14-5
Molekyylikaava: NaCl
molekyylipaino: 58.44280
tarkka massa: 57.95860
turvatiedot
tullikoodeksi: 2501002000
vaaraluokkakoodi: R36; r22
Turvallisuusohjeet: S24 / 25-S26
vaarallisten aineiden merkki: xi
natriumkloridin fysikaaliset ominaisuudet
ulkonäkö ja ominaisuudet: väritön kristalli-tai valkohittijauhe
tiheys: 2.165 g / cm3 (25 ° c)
Vesiliukoisuus: 360 g / L (25 ºC)
stabiilisuus: Vakaa normaaleissa kuljetus-ja käsittelyolosuhteissa.
varastointiolosuhteet: alhainen lämpötila, ilmanvaihto ja varasto
Höyrynpaine: 1 mm Hg (865 ° c)
sulamispiste: 801 ° c
Kiehumispiste: 1465 ℃
natriumkloridi on valkoista hajutonta kiteistä jauhetta. Mp 801 astetta.] C, kiehumispiste 1465 astetta.] C, liukenee hieman etanoliin, propanoliin, butaaniin, butaaniin ja kun plasma sekoittuu, liukenee veteen, vesiliukoisuus 35,9 g (huoneenlämpötila).
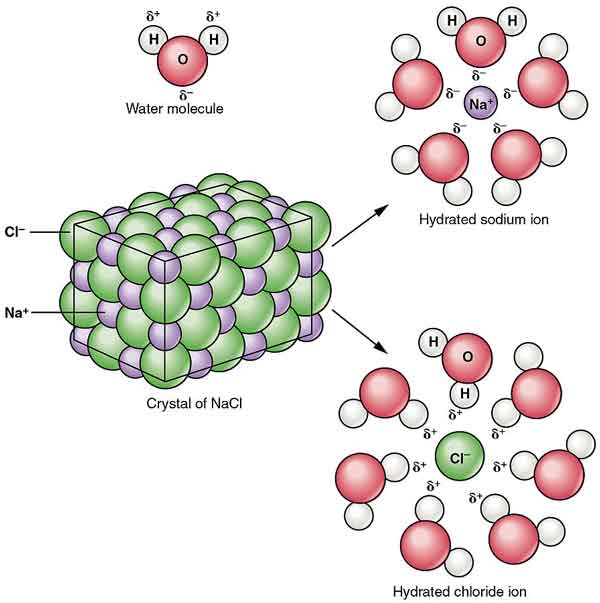
NaCl hajoaa alkoholiin muodostaen kolloideja. Sen liukoisuus veteen vähenee vetykloridin läsnä ollessa, ja se on lähes liukenematonta väkevään suolahappoon.
natriumkloridin kemialliset ominaisuudet
natriumkloridin kiteet muodostavat stereosymmetrian. Kiderakenteeltaan suuremmat kloridi-ionit muodostavat kuution tiheimmän pakkauksen ja pienemmät natriumionit täyttävät kloridi-ionien välisen oktaedrisen aukon. Each ion is surrounded by six other ions. This structure is also found in many other compounds, called sodium chloride type structure or stone salt structure.

1. Preparationof sodium metal by electrolytic melting of sodium chloride
2NaCl(molten) = 2Na + Cl2
2. Electrolytic saltwater
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
3. React withsilver nitrate
NaCl + AgNO3 = NaNO3 + AgCl
Ionic equation:
Cl– + Ag+ = AgCl
(Which is theessence CI – property)
4. Reaction withconcentrated sulfuric acid (laboratory hydrogen chloride)
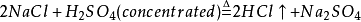

( Concentrated behalfconcentrated, Excess Representative excess)
5.NaCl test
A: kloridi lisättiin pisaroittain liuokseen typpihappoa oli hapotettu liuos hopeanitraattia, valkoinen saostuma (saostettu hopeakloridi) syntyy, osoittautunut CI– .
B: kasta pieni määrä liuosta platinalangalla ja laita se alkoholilamppuun palamaan. Liekki on keltainen ja voidaan todistaa, että se sisältää Na+.
C: häiriöiden poistamiseksi alkuperäistä testiliuosta voidaan lisätä kyllästetyllä bariumhydroksidilla, kunnes se on selvästi emäksistä. Tällöin useimmat kationit ja anionit, kuten PO43− ja AsO43− saostuvat.
testiliuokseen lisätty Ba2+ poistetaan ammoniumkarbonaatilla ja lopuksi ammoniumsuola poistetaan polttamalla. Kun jäännös oli huuhtoutunut vedellä, liuos happamoitiin HAc: lla ja uranyylisinkkiasetaattireagenssia lisättiin pisaroiden määrän mukaan 1: 8, ja putken seinämää hierottiin lasisauvalla. Jos muodostui sitruunankeltaisia kiteitä, Na+ oli läsnä.
natriumkloridin valmistus
teollinen menetelmä
Suolapelloille meriveden mukana (keskimäärin 2.4% natriumkloridia) ja kuivattu auringossa, tiivistetty kiteytymään raakatuotteen saamiseksi. Merivettä voidaan myös kuumentaa höyryllä, suodattaa hiekkasuodattimella ja konsentroida ioninvaihtokalvon elektrodialyysillä, jolloin saadaan suolavettä (sisältää natriumkloridia 160-180 g / L).
halokipsi saostuu haihduttamalla, ja saatu kloriini sentrifugoidaan. Yli 95% natriumia (2% kosteutta) voidaan kuivata saadayhteinen suola. Vuorisuolaa ja Suolajärven suolavettä voidaan käyttää myös raakamateriaalina ja kuivata auringossa raakasuolan saamiseksi.
kun raaka – aineina käytetään maanalaista suolavettä ja kaivosuolaa, ne hajaantuvat kolme-tai nelivaikutteisella haihdutuksella, kiteet saostuvat ja sentrifugoidaan,jotta saadaan.
laboratoriomenetelmä
raakasuola liuotetaan veteen liukenemattomien epäpuhtauksien poistamiseksi, ja jalostettuja valmisteita, kuten natriumhydroksidia ja natriumkarbonaattia lisätään, jotta liukoiset epäpuhtaudet, kuten SO42 -, Ca2+ ja Mg2+, saostuvat, suodatetaan poistamiseksi ja lopuksi puhdistetaan pH: lla, joka säädetään arvoon 7 suolahapolla, ja liuos konsentroidaan puhtaiden natriumkloridikiteiden saamiseksi.
laboratoriossa valmistemetodina on sekoittaa yhtä suuri määrä kloorivetyhappoa natriumhydroksidin kanssa natriumkloridiliuokseksi. Liuos tislattiin siten, että saatiin natriumkloridikiteitä. Pääreaktio:
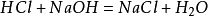
lisäksi natriumkloridi tuottaa myös natriumkloridia sytytettäessä kloorikaasun ympäristöön. Sen kemiallinen yhtälö on:
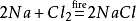
mihin natriumkloridia käytetään
teollisuudessa
1. Kun elektrolyyttistä natriumkloridiliuosta onsektrolysoitu, syntyy vetyä ja kloorikaasua. Kloorikaasulla on laaja valikoima sovelluksia kemianteollisuudessa, ja sitä voidaan käyttää synteettisten polyvinyylikloridin, torjunta-aineiden, suolahapon jne.
2. Natriummetallin valmistus dangs-menetelmällä: natriummetallin valmistus elektrolyyttisesti sulattamalla natriumkloridin ja kalsiumkloridin seos. Kalsiumkloridia käytetään vuonaan alentamaan natriumkloridin sulamispistettä alle 700 ° C. kalsium on vähemmän vähentävää kuin natrium eikä aiheuta epäpuhtauksia.
3. Natriumkloridi on välttämätön monille biologisille reaktioille. Esimerkiksi erilaiset molekyylibiologiakokeet sisältävät natriumkloridia, ja suurin osa bakteeriviljelmästä sisältää natriumkloridia. Se on myös raaka – aine tuotannossa ofsoda tuhka ammoniakki-alkali menetelmällä.
4. Epäorgaanista ja orgaanista teollisuutta käytetään raaka-aineina kaustisen soodan, kloraatin, hypokloriitin, vaalennusjauheen, jäähdytysjärjestelmien kylmäaineiden, orgaanisen synteesin ja suolausaineiden raaka-aineina. Terästeollisuutta käytetään lämpökäsittelyaineena. Korkean lämpötilan lämmönlähdettä käytetään suolahauteen muodostamiseen kaliumkloridin, bariumkloridin jne., jota voidaan käyttää lämmitysaineena lämpötilan ylläpitämiseksi 820-960 ° C. Lisäksi sitä käytetään myös lasi -, väriaine -, Metallurgia-ja muilla teollisuudenaloilla.
5. Analyyttisiä reagensseja käytetään fluori-ja silikatetra-analyysireagensseina.
6. Soodan valmistus Hou: n alkalimenetelmällä: toinen vaihe: ensimmäisessä vaiheessa valmistettu ammoniumbikarbonaattiliuos sekoitetaan natriumkloridiliuokseen, jolloin saadaan natriumbikarbonaattia jaammoniumkloridia 10°C: n lämpötilassa.
elintarviketeollisuus
elintarviketeollisuutta ja kalastusta käytetään suolaamiseen sekä mausteiden ja puhdistetun pöytäsuolan raaka-aineita.
suolan lisääminen keittoruokiin voi poistaa jonkin verran raaka-aineiden tuoksua ja lisätä makua, mikä on suolareseptin vaikutus. ”Hieman mauton, suolainen ja mauton” tarkoittaa, ettäoikea määrä suolaa voidaan käyttää sen ainutlaatuisia toimintoja.
lääketieteellinen
natriumkloridi on erittäin tärkeä koko maanpäällisen elämän kannalta. Useimmat biologiset kudokset sisältävät useita suoloja. Natriumin pitoisuus veressä liittyy suoraan kehon nesteiden turvallisen tason säätelyyn. Natriumionit säätelevät myös signaalimuunnoksen aiheuttamien hermoimpulssien johtumista.
vettä, joka sisältää 0, 9% natriumkloridia, kutsutaan saliiniksi, koska sillä on sama osmoottinen paine kuin plasmalla. Normaali suolaliuos on tärkein nesteenkorvike. Sitä käytetään laajalti dehydraation hoidossa ja ehkäisyssä, ja sitä käytetään myös suonensisäisen injektion hoidossa ja hypovoleemisen sokin estämisessä.
toisin kuin muut kädelliset, ihmiset erittävät suuria määriä natriumkloridia hikoilun kautta.
natriumkloridi on välttämätön humaaneille. Aikuisten sisältämien natriumionien kokonaismäärä on noin 60 g,josta 80% on solunulkoisessa nesteessä eli plasmassa ja solujen välisessä fluidissa. Kloridia esiintyy myös pääasiassa solunulkoisessa nesteessä. Natrium-ja kloridi-ionien fysiologiset tehtävät ovat:
(1) ylläpitäen solunulkoisen nesteen osmoottista painetta.
(2) osallistuu elimistön happo-emästasapainon säätelyyn.
(3) kloridi osallistuu elimistön kastriinihapon tuotantoon. Lisäksi natriumkloridilla on myös roolihermojen ja lihasten normaalin jännittävyyden ylläpitäminen.
maataloudessa
sen vesiliuosta voidaan käyttää siementen poimintaan. NaCl-ratkaisu on konfiguroitu potilaiden tarpeiden mukaan, ja sen tiheys on suurempi kuin veden. Siemenet laitetaan intoNaCl ratkaisu, kelluva täynnä ja uppoaminen täynnä.
muut
SingaporeScience and Technology Research Instituten julkaisemien uusien tutkimustulosten mukaan natriumkloridi voi merkittävästi lisätä kiintolevyjen kapasiteettia. Erityisesti, existingconventional kiintolevy käyttää satunnaisesti kohdennettua magneettilevyn tallennusteknologia, joka voi saavuttaa vain tiedon tiheys 0,5 TB per neliötuumaa.
uusi tekniikka hyötyy natriumkloridin avulla. Uuden korkean resoluution litografiakertoimiteknologian avulla datadensiteetti on järjestyneempi ja saavuttaa 3.3TB neliötuumaa kohti ilman tarvetta monimutkaisiin laitteiden päivityksiin. Käyttämällä 1TB kiintolevy tämän teknologian voi saavuttaa 6TB kapasiteetti lisäämättä levyjä.
- ammoniakin kaava || miksi ammoniakki on myrkyllistä || Ammoniakkimyrkytys
- miksi otsonikerros on tärkeä || otsonikerroksen ohentuminen
- mikä on liuoksen pitoisuus || miten pitoisuus vaikuttaa reaktioon
- miksi Hiilikierto on tärkeä || miten se toimii
- Haloalkaanien ja Haloareenien NCERT-liuokset || Haloalkaanin rakenne
- Hiilidioksidikierto ja kaava || miten hiilidioksidia syntyy
Leave a Reply