Konsentrasjon Av Hydrogenioner

neste oppstår spørsmålet om hva som bestemmer surheten eller alkaliteten til en løsning.
Faktisk bestemmes det av konsentrasjonen av hydrogenioner, prosentandelen hydrogenioner inneholdt i løsningen.
la oss ta vann som et eksempel.
som du vet, er formelen for vann H2O. De Fleste molekylene i vann er i den ekstremt stabile formen vi kjenner SOM H2O.en svært liten prosentandel av disse molekylene har imidlertid brutt opp i hydrogenioner (H+) og hydroksidioner, (OH -), som illustrert i figuren.Faktisk bestemmer denne balansen mellom hydrogenioner og hydroksidioner pH i vannet.
når hydrogenioner overstiger hydroksidioner, er løsningen sur. Hvis omvendt er sant, er løsningen alkalisk.
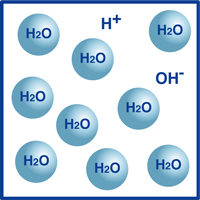
hvis temperaturen ikke varierer, finnes følgende forhold mellom tetthetene av hydrogenioner (H+) og hydroksidioner (OH-) med noen løsning:
=Kw=10-14 (=fast) ved 25℃
(Kw kalles ionproduktet av vann eller dissosiasjonskonstanten av vann.)
i rent vann eller nøytral løsning gjelder følgende formel, fordi
=,
==√(Kw)=√10-14=10-7
hvis du vet verdien av en eller , kan du finne verdien av den andre.
Dermed måler vi bare og bruker det som standard for pH. på denne måten bestemmes pH av hydrogenionkonsentrasjon.

Så er pH definert av følgende formel:
pH= – log10
konsentrasjonen av hydrogenioner i en hvilken som helst løsning vi sannsynligvis vil møte, vil variere fra 1 mol til 0,000001 mol per liter løsning. Imidlertid kan løsninger med ekstremt lav hydrogenionkonsentrasjon tenkes å rake opp en ganske lang parade av nuller etter desimaltegnet. Den danske biokjemikeren S. P. L. Sorensen var den første som brukte pH-systemet vi kjenner i dag, som definerer inverse antall hydrogenionkonsentrasjoner vist i felles logaritme som pH. Det vil si,
pH= – log10
i tilfelle av en nøytral løsning,
=10-7, som vi kaller en pH på 7.
Dette betyr for eksempel at en hydrogenionkonsentrasjon av en løsning med en pH på 4 er 10-4mol / l, noe som betyr at den inneholder 0,0001 mol hydrogenioner i en løsning på 1 liter. På samme måte inneholder en løsning med en pH på 5 10-5mol/l hydrogenioner, en løsning med en pH på 6 inneholder 10-6mol/l hydrogenioner, mens løsningen med en pH på 7 inneholder 10-7mol/l hydrogenioner. Du vil legge merke til at hvis du sammenligner løsninger med pH på 4 og pH på 7, er forskjellen i pH bare 3, men konsentrasjonen av hydrogenioner med en pH på 7 er 1000 ganger så høy som med en pH på 4.Følgende figur viser også fordelen av eksponenter, som kan uttrykke store variasjoner i verdi som spenner over mange størrelsesordener.
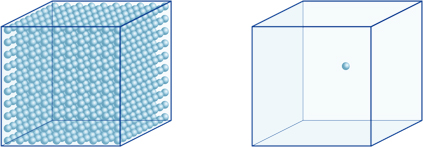
antallet hydrogenioner i kuben til venstre (10-4mol/L) er 1000 ganger større enn i den til høyre (10-7mol / L); dette tilsvarer en forskjell på 3 i pH-verdien. (En enkelt blå ball representerer 10-7mol/L hydrogenioner.)
Neste Side Hydrogen-Ion Aktivitet
Leave a Reply