Concentration d’ions hydrogène

Se pose ensuite la question de savoir ce qui détermine l’acidité ou l’alcalinité d’une solution.
En fait, il est déterminé par la concentration en ions hydrogène, le pourcentage d’ions hydrogène contenus dans la solution.
Prenons l’eau comme exemple.
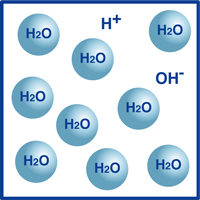
Comme vous le savez, la formule de l’eau est H2O. La plupart des molécules dans l’eau sont sous cette forme extrêmement stable que nous connaissons sous le nom de H2O.
Cependant, un très faible pourcentage de ces molécules se sont décomposées en ions hydrogène (H+) et en ions hydroxyde (OH-), comme illustré sur la figure.
En fait, cet équilibre d’ions hydrogène et d’ions hydroxyde détermine le pH de l’eau.
Lorsque les ions hydrogène sont plus nombreux que les ions hydroxyde, la solution est acide. Si l’inverse est vrai, la solution est alcaline.
Si la température ne varie pas, la relation suivante entre les densités des ions hydrogène (H +) et des ions hydroxyde (OH-) est trouvée avec n’importe quelle solution:
= Kw = 10-14 (= fixe) à 25 ℃
(Kw est appelé le produit ionique de l’eau ou la constante de dissociation de l’eau.)
Dans de l’eau pure ou une solution neutre, la formule suivante est vraie, car
=,
== √(Kw)= √10-14= 10-7
Si vous connaissez la valeur de l’un ou de l’autre, vous pouvez trouver la valeur de l’autre.
Ainsi, nous mesurons uniquement et l’utilisons comme étalon de pH. De cette manière, le pH est déterminé par la concentration en ions hydrogène.

Ainsi, le pH est défini par la formule suivante:
pH=-log10
La concentration en ions hydrogène dans toute solution que nous sommes susceptibles de rencontrer variera de 1 mole à 0,000001 mole par litre de solution. Cependant, des solutions avec une concentration d’ions hydrogène extrêmement faible pourraient éventuellement accumuler un assez long défilé de zéros après la virgule décimale. Le biochimiste danois S.P.L. Sorensen a été le premier à utiliser le système de pH que nous connaissons aujourd’hui, qui définit les nombres inverses de concentration en ions hydrogène indiqués dans le logarithme commun comme pH. C’est-à-dire,
pH=-log10
Dans le cas d’une solution neutre,
= 10-7, ce que l’on appelle un pH de 7.
Cela signifie, par exemple, qu’une concentration en ions hydrogène d’une solution avec un pH de 4 est de 10-4mol /l, ce qui signifie qu’elle contient 0,0001 mole d’ions hydrogène dans une solution de 1 litre. De la même manière, une solution avec un pH de 5 contient 10-5mol / l d’ions hydrogène, une solution avec un pH de 6 contient 10-6mol / l d’ions hydrogène, tandis que la solution avec un pH de 7 contient 10-7mol / l d’ions hydrogène. Vous remarquerez que si vous comparez des solutions avec un pH de 4 et un pH de 7, la différence de pH n’est que de 3, mais la concentration d’ions hydrogène avec un pH de 7 est 1000 fois plus élevée qu’avec un pH de 4.La figure suivante montre également l’avantage des exposants, qui peuvent exprimer de grandes variations de valeur allant sur plusieurs ordres de grandeur.
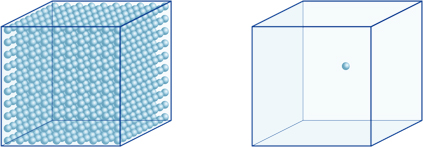
Le nombre d’ions hydrogène dans le cube de gauche (10-4mol / L) est 1000 fois plus grand que dans celui de droite (10-7mol / L); cela équivaut à une différence de 3 dans la valeur du pH. (Une seule boule bleue représente 10-7mol/L d’ions hydrogène.)
Page suivante Activité des ions hydrogène
Leave a Reply