Concentración de Iones de Hidrógeno

A continuación surge la pregunta de qué determina la acidez o alcalinidad de una solución.
En realidad, se determina por la concentración de iones de hidrógeno, el porcentaje de iones de hidrógeno contenidos en la solución.Tomemos el agua como ejemplo.Como saben, la fórmula para el agua es H2O. La mayoría de las moléculas en el agua están en esa forma extremadamente estable que conocemos como H2O.
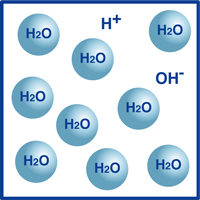
Sin embargo, un porcentaje muy pequeño de esas moléculas se han dividido en iones de hidrógeno (H+) e iones de hidróxido (OH -), como se ilustra en la figura.
En realidad, este equilibrio de iones de hidrógeno e iones de hidróxido determina el pH del agua.
Cuando los iones de hidrógeno superan en número a los iones de hidróxido, la solución es ácida. Si lo contrario es cierto, entonces la solución es alcalina.
Si la temperatura no varía, la siguiente relación entre las densidades de iones de hidrógeno (H+) e iones de hidróxido (OH-) se encuentra con cualquier solución:
=Kw = 10-14 (=fijo) a 25℃
(Kw se denomina producto iónico del agua o constante de disociación del agua.)
En agua pura o solución neutra, la siguiente fórmula es válida, porque
= ,
==√(Kw)=√10-14=10-7
Si conoce el valor de uno de los o , puede encontrar el valor del otro.
Por lo tanto, solo medimos y lo usamos como el estándar para el pH. De esta manera, el pH se determina por la concentración de iones de hidrógeno.

Entonces, el pH se define mediante la siguiente fórmula:
pH=-log10
La concentración de iones de hidrógeno en cualquier solución que probablemente encontrará una amplia gama que va desde 1 mol de a 0.000001 moles por litro de solución. Sin embargo, las soluciones con una concentración extremadamente baja de iones de hidrógeno podrían acumular un desfile bastante largo de ceros después del punto decimal. El bioquímico danés S. P. L. Sorensen fue el primero en utilizar el sistema de pH que conocemos hoy en día, que define los números inversos de concentración de iones de hidrógeno que se muestran en el logaritmo común como pH. Es decir,
pH=-log10
En el caso de una solución neutra,
=10-7 , a la que llamamos un pH de 7.
Esto significa, por ejemplo, que una concentración de iones de hidrógeno de una solución con un pH de 4 es de 10-4mol/l, lo que significa que contiene 0,0001 mol de iones de hidrógeno en una solución de 1 litro. De la misma manera, una solución con un pH de 5 contiene 10-5mol/l de iones de hidrógeno, una solución con un pH de 6 contiene 10-6mol/l de iones de hidrógeno, mientras que la solución con un pH de 7 contiene 10-7mol/l de iones de hidrógeno. Notará que si compara soluciones con pH de 4 y pH de 7, la diferencia en pH es solo 3, pero la concentración de iones de hidrógeno con un pH de 7 es 1000 veces más alta que con un pH de 4.La siguiente figura también muestra la ventaja de los exponentes, que pueden expresar grandes variaciones en el valor que varían en muchos órdenes de magnitud.
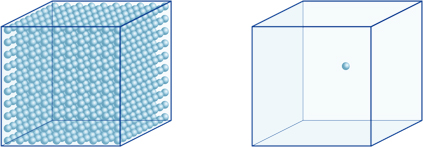
El número de iones de hidrógeno en el cubo de la izquierda (10-4mol/L) es 1.000 veces mayor que en el de la derecha (10-7mol / L); esto equivale a una diferencia de 3 en el valor de pH. (Una sola bola azul representa 10-7mol / L de iones de hidrógeno.)
Página siguiente Actividad de iones de hidrógeno
Leave a Reply