Konzentration von Wasserstoffionen

Als nächstes stellt sich die Frage, was den Säuregehalt oder die Alkalität einer Lösung bestimmt.Tatsächlich wird es durch die Konzentration von Wasserstoffionen bestimmt, den Prozentsatz der in der Lösung enthaltenen Wasserstoffionen.
Nehmen wir Wasser als Beispiel.
Wie Sie wissen, lautet die Formel für Wasser H2O. Die meisten Moleküle im Wasser sind in dieser extrem stabilen Form, die wir als H2O kennen.Ein sehr winziger Prozentsatz dieser Moleküle ist jedoch in Wasserstoffionen (H +) und Hydroxidionen (OH-) zerfallen, wie in der Abbildung dargestellt.Tatsächlich bestimmt dieses Gleichgewicht von Wasserstoffionen und Hydroxidionen den pH-Wert des Wassers.
Wenn die Wasserstoffionen die Hydroxidionen überwiegen, ist die Lösung sauer. Wenn das Gegenteil der Fall ist, ist die Lösung alkalisch.
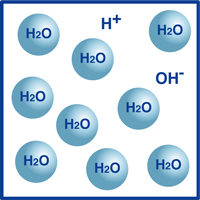
Wenn die Temperatur nicht variiert, wird bei jeder Lösung die folgende Beziehung zwischen den Dichten von Wasserstoffionen (H+) und Hydroxidionen (OH-) gefunden:
= Kw = 10-14 (= fest) bei 25 ℃
(Kw wird als Ionenprodukt von Wasser oder Dissoziationskonstante von Wasser bezeichnet.)
In reinem Wasser oder neutraler Lösung gilt die folgende Formel, weil
= ,
==√(Kw)=√10-14=10-7
Wenn Sie den Wert von entweder oder kennen, können Sie den Wert des anderen finden.
Daher messen wir nur und verwenden es als Standard für den pH-Wert. Auf diese Weise wird der pH-Wert durch die Wasserstoffionenkonzentration bestimmt.

Der pH-Wert wird also durch die folgende Formel definiert:
pH= -log10
Die Konzentration von Wasserstoffionen in jeder Lösung, der wir wahrscheinlich begegnen, liegt zwischen 1 mol und 0,000001 mol pro Liter Lösung. Lösungen mit extrem niedriger Wasserstoffionenkonzentration könnten jedoch möglicherweise eine ziemlich lange Parade von Nullen nach dem Komma bilden. Der dänische Biochemiker S.P.L. Sorensen war der erste, der das heute bekannte pH-System verwendete, das inverse Zahlen der Wasserstoffionenkonzentration definiert, die im allgemeinen Logarithmus als pH-Wert angezeigt werden. Das heißt,
pH=-log10
Im Falle einer neutralen Lösung
=10-7 , was wir einen pH-Wert von 7 nennen.Dies bedeutet beispielsweise, dass eine Wasserstoffionenkonzentration einer Lösung mit einem pH-Wert von 4 10-4mol/l beträgt, was bedeutet, dass sie 0,0001 mol Wasserstoffionen in einer Lösung von 1 Liter enthält. In gleicher Weise enthält eine Lösung mit einem pH-Wert von 5 10-5 mol / l Wasserstoffionen, eine Lösung mit einem pH-Wert von 6 10-6 mol / l Wasserstoffionen, während die Lösung mit einem pH-Wert von 7 10-7 mol / l Wasserstoffionen enthält. Sie werden feststellen, dass beim Vergleich von Lösungen mit einem pH-Wert von 4 und einem pH-Wert von 7 der Unterschied im pH-Wert nur 3 beträgt, die Konzentration von Wasserstoffionen bei einem pH-Wert von 7 jedoch 1000-mal so hoch ist wie bei einem pH-Wert von 4.Die folgende Abbildung zeigt auch den Vorteil von Exponenten, die große Wertschwankungen ausdrücken können, die sich über viele Größenordnungen erstrecken.
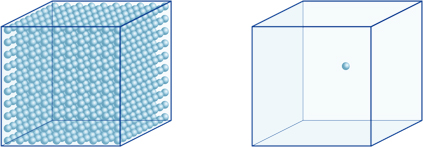
Die Anzahl der Wasserstoffionen im Würfel links (10-4mol/L) ist 1.000 mal größer als im Würfel rechts (10-7mol/L); dies entspricht einer Differenz von 3 im pH-Wert. (Eine einzelne blaue Kugel repräsentiert 10-7 mol / l Wasserstoffionen.)
Nächste Seite Wasserstoff-Ionen-Aktivität
Leave a Reply