Concentração de Íons de Hidrogênio

em seguida, surge a questão do que determina a acidez ou alcalinidade de uma solução.na verdade, é determinado pela concentração de íons de hidrogênio, a percentagem de íons de hidrogênio contida na solução.tomemos a água como exemplo.como você sabe, a fórmula para a água é H2O. a maioria das moléculas na água estão nessa forma extremamente estável que conhecemos como H2O.no entanto, uma percentagem muito pequena dessas moléculas dividiu-se em íons de hidrogênio (H+) e íons de hidróxido (OH -), como ilustrado na figura.na verdade, este equilíbrio de íons de hidrogênio e íons de hidróxido determina o pH da água.quando os íons de hidrogênio superam os íons de hidróxido, a solução é ácida. Se o inverso for verdadeiro, então a solução é alcalina.
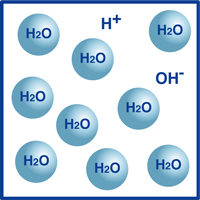
Se a temperatura não variar, a seguinte relação entre as densidades dos iões hidrogénio (H+) e dos iões hidróxido (OH-) é encontrada com qualquer solução:
=Kw = 10-14 (=fixo) a 25℃
(Kw é chamado de produto iónico da água ou constante de dissociação da água.)
Em água pura ou solução neutra, a seguinte fórmula é verdadeiro, porque
= ,
==√(Kw)=√10-14=10-7
Se você sabe o valor de uma ou , você pode encontrar o valor da outra.desta forma, o pH é determinado pela concentração de íons hidrogênio.

So, pH é definido pela seguinte fórmula::
pH=-log10
a concentração de íons de hidrogénio em qualquer solução que possamos encontrar irá variar de 1 mol a 0,000001 mol por litro de solução. No entanto, soluções com uma concentração extremamente baixa de íons de hidrogênio poderiam possivelmente acumular um desfile bastante longo de zeros após o ponto decimal. O bioquímico Dinamarquês S. P. L. Sorensen foi o primeiro a usar o sistema de pH que conhecemos hoje, que define números inversos de concentração de íons de hidrogênio mostrado no logaritmo comum como pH. Isto é,
pH=-log10
no caso de uma solução neutra,
=10-7 , que chamamos de pH de 7.isto significa, por exemplo, que uma concentração de íons hidrogênio de uma solução com um pH de 4 é 10-4mol/l, o que significa que contém 0,0001 mol de íons hidrogênio em uma solução de 1 litro. Da mesma forma, uma solução com um pH de 5 contém 10-5mol/l de íons de hidrogênio, uma solução com um pH de 6 contém 10-6mol/l de íons de hidrogênio, enquanto a solução com um pH de 7 contém 10-7mol/l de íons de hidrogênio. Você vai notar que se você comparar soluções com pH de 4 e pH de 7, a diferença em pH é apenas 3, mas a concentração de íons hidrogênio com um pH de 7 é 1000 vezes mais alta do que com um pH de 4.A figura seguinte também mostra a vantagem dos expoentes, que podem expressar grandes variações de valor que variam ao longo de muitas ordens de magnitude.
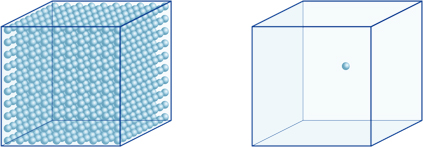
O número de íons de hidrogênio no cubo da esquerda (10-4mol/L) é 1.000 vezes maior do que a da direita (10-7mol/L); isto é equivalente a uma diferença de 3, no valor de pH. (Uma única bola azul representa 10-7mol / L de íons de hidrogênio.)
Próxima página actividade hidrogénio-Ião
Leave a Reply