Stężenie jonów wodorowych

następnie pojawia się pytanie, co decyduje o kwasowości lub zasadowości roztworu.
w rzeczywistości jest ona określona przez stężenie jonów wodorowych, procent jonów wodorowych zawartych w roztworze .
weźmy wodę jako przykład.
Jak wiecie, wzorem dla wody jest H2O. większość cząsteczek w wodzie jest w tej niezwykle stabilnej formie, którą znamy jako H2O.
jednak bardzo mały procent tych cząsteczek rozpadł się na jony wodorowe (H+) i jony wodorotlenkowe (OH -), jak pokazano na rysunku.
W rzeczywistości ta równowaga jonów wodorowych i wodorotlenowych determinuje pH wody.
gdy jony wodorowe przewyższają jony wodorotlenkowe, roztwór jest kwaśny. Jeśli odwrotność jest prawdziwa, to roztwór jest alkaliczny.
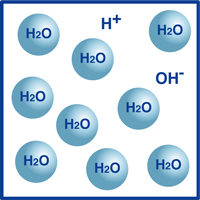
Jeśli temperatura nie zmienia się, w dowolnym roztworze występuje następująca zależność między gęstością jonów wodorowych (H+) i jonów wodorotlenkowych (OH -):
=Kw = 10-14 (=stała) przy 25℃
(Kw nazywa się produktem jonowym wody lub stałą dysocjacji wody.)
w czystej wodzie lub roztworze neutralnym następujący wzór jest prawdziwy, ponieważ
=,
==√(Kw)=√10-14=10-7
Jeśli znasz wartość jednego lub, możesz znaleźć wartość drugiego.
tak więc mierzymy tylko i używamy go jako wzorca dla pH. w ten sposób pH jest określane przez stężenie jonów wodorowych.

więc pH jest zdefiniowane następującym wzorem:
pH=-log10
stężenie jonów wodorowych w dowolnym roztworze, który prawdopodobnie napotkamy, będzie wynosić od 1 mola do 0,000001 mola na litr roztworu. Jednak roztwory o ekstremalnie niskim stężeniu jonów wodorowych mogłyby wytworzyć dość długą paradę zer po przecinku dziesiętnym. Duński biochemik S. P. L. Sorensen jako pierwszy użył znanego dziś systemu pH, który definiuje odwrotne liczby stężenia jonów wodorowych pokazane w logarytmie potocznym jako pH. Oznacza to, że
pH=-log10
w przypadku roztworu neutralnego,
=10-7, które nazywamy pH 7.
oznacza to na przykład, że stężenie jonów wodorowych w roztworze o pH 4 wynosi 10-4mol/l, co oznacza, że zawiera 0,0001 mola jonów wodorowych w roztworze o pojemności 1 litra. W ten sam sposób roztwór o pH 5 zawiera 10-5mol/l jonów wodorowych, roztwór o pH 6 zawiera 10-6mol/l jonów wodorowych, podczas gdy roztwór o pH 7 zawiera 10-7mol/l jonów wodorowych. Zauważysz, że jeśli porównasz roztwory o pH 4 i pH 7, różnica w pH wynosi tylko 3, ale stężenie jonów wodorowych o pH 7 jest 1000 razy wyższe niż przy pH 4.Poniższy rysunek pokazuje również zalety wykładników, które mogą wyrażać duże zmiany wartości w zakresie wielu rzędów wielkości.
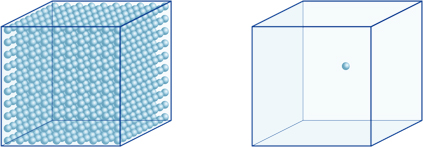
liczba jonów wodorowych w kostce po lewej stronie (10-4mol/L) jest 1000 razy większa niż w kostce po prawej (10-7mol / L); jest to równoważne różnicy 3 w wartości pH. (Pojedyncza niebieska kula reprezentuje 10-7mol / L jonów wodorowych.)
Następna strona aktywność jonów wodorowych
Leave a Reply