Vetyionien konsentraatio

seuraavaksi herää kysymys, mikä määrittää liuoksen happamuuden tai emäksisyyden.
itse asiassa se määräytyy vetyionien konsentraation eli liuoksen sisältämien vetyionien prosenttiosuuden perusteella.
otetaan esimerkiksi vesi.
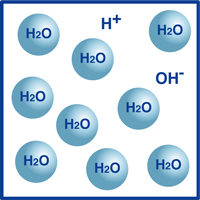
kuten tiedätte, veden kaava on H2O. suurin osa veden molekyyleistä on siinä äärimmäisen stabiilissa muodossa, jonka tunnemme H2O: na.
kuitenkin hyvin pieni osa näistä molekyyleistä on hajonnut vetyioneiksi (H+) ja hydroksidi-ioneiksi (OH -), kuten kuviosta käy ilmi.
itse asiassa tämä vetyionien ja hydroksidi-ionien tasapaino määrää veden pH: n.
kun vetyioneja on enemmän kuin hydroksidi-ioneja, liuos on hapan. Jos päinvastainen on totta, liuos on emäksinen.
Jos lämpötila ei vaihtele, minkä tahansa liuoksen kanssa saadaan seuraava suhde vetyionien (H+) ja hydroksidi-ionien (OH -) tiheyksien välillä:
=Kw=10-14(=kiinteä) lämpötilassa 25℃
(Kw: ta kutsutaan veden ionituloksi tai veden dissosiaatiovakioksi.)
puhtaassa vedessä tai neutraalissa liuoksessa pätee seuraava kaava, koska
=,
=√(Kw)=√10-14=10-7
Jos tietää jommankumman tai toisen arvon, voi löytää toisen arvon.
näin mittaamme vain ja käytämme sitä pH: n standardina. näin pH määräytyy vety-ionikonsentraation perusteella.

joten pH määritellään seuraavalla kaavalla:
pH=-log10
vetyionien pitoisuus missä tahansa todennäköisesti kohtaamassamme liuoksessa vaihtelee välillä 1 mol-0,000001 mol litrassa liuosta. Kuitenkin ratkaisut, joilla on erittäin alhainen vety-ionipitoisuus, voisivat mahdollisesti kerätä melko pitkän paraatin nollia desimaalipilkun jälkeen. Tanskalainen biokemisti S. P. L. Sorensen käytti ensimmäisenä nykyään tuntemaamme pH-järjestelmää, jossa yhteisessä logaritmissa esitettyjen vety-ionikonsentraatioiden käänteisluvut määritellään pH: ksi. Toisin sanoen
pH=-log10
neutraalin ratkaisun tapauksessa
=10-7, jota kutsumme pH: ksi 7.
tämä tarkoittaa esimerkiksi sitä, että vedyn ionipitoisuus liuoksessa, jonka pH on 4, on 10-4mol / l, eli se sisältää 0,0001 mol vetyioneja 1 litran liuoksessa. Vastaavasti liuos, jonka pH on 5, sisältää 10-5mol/l vetyioneja, liuos, jonka pH on 6, sisältää 10-6mol/l vetyioneja, kun taas liuos, jonka pH on 7, sisältää 10-7mol/l vetyioneja. Huomaat, että jos vertaat liuoksia pH: n kanssa 4 ja pH: n kanssa 7, ero pH: ssa on vain 3, mutta vetyionien pitoisuus, jonka pH on 7, on 1000 kertaa niin suuri kuin pH: n kanssa 4.Seuraavassa kuvassa näkyy myös eksponenttien ETU, jotka voivat ilmaista suuria arvonvaihteluita, jotka vaihtelevat useiden suuruusluokkien välillä.
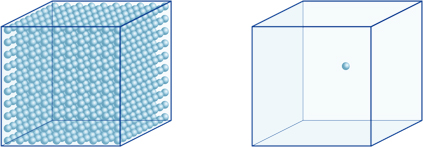
vetyionien lukumäärä vasemmalla olevassa kuutiossa (10-4mol/L) on 1 000 kertaa suurempi kuin oikealla olevassa kuutiossa (10-7mol / L); tämä vastaa 3: n eroa pH-arvossa. (Yksi sininen pallo edustaa 10-7mol/L vetyioneja.)
Seuraava sivu vety-Ioniaktiivisuus
Leave a Reply