Összehasonlítása Erőssége Oxidánsok, valamint Reductants
Tanulási Célok
- Azonosítani, hogy megtekintéséhez Standard Csökkentési Potenciálok szempontból életképes, csökkenti, illetve oxidáló szerekkel a REDOX reakciók.
a vegyi anyagok széles skálájára mérhetjük a standard potenciált, amelyek közül néhány szerepel a P2 táblázatban. Ezek az adatok lehetővé teszik számunkra, hogy összehasonlítsuk a különböző anyagok oxidatív és reduktív erősségeit. A standard hidrogénelektród (SHE) félreakciója több mint félúton fekszik a \(\PageIndex{1}\) táblázatban. Minden olyan reagens, amely a táblázatban a nő alatt fekszik, erősebb oxidálószerek, mint a H+, és mindazok, amelyek a fölött fekszenek, gyengébbek. A táblázat legerősebb oxidálószere az F2, standard elektródpotenciálja 2,87 V. Ez a magas érték összhangban van a fluor nagy elektronegativitásával, és azt mondja nekünk, hogy a fluor erősebb hajlamot mutat az elektronok elfogadására (erősebb oxidálószer), mint bármely más elem.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
nem minden oxidálószer és reduktor egyenlő. A \(\PageIndex{1}\) táblázat standard redukciós potenciálja úgy értelmezhető, mint az anyagok oxidáló és redukáló erejük szerinti rangsorolása. Az erős oxidálószerek jellemzően olyan vegyületek, amelyek nagy oxidációs állapotban lévő elemekkel vagy nagy elektronegativitással rendelkeznek, amelyek elektronokat nyernek a redox reakcióban (\(\PageIndex{1}\). Az erős oxidálószerek közé tartozik a hidrogén-peroxid, a permanganát, az ozmium-tetroxid. A redukálószerek jellemzően elektropozitív elemek, például hidrogén, lítium, nátrium, vas és alumínium, amelyek redox reakciókban elektronokat veszítenek el. A szerves és organometallikus reakciókban gyakran alkalmaznak hidrideket (formai -1 oxidációs állapotban hidrogént tartalmazó vegyületeket), például nátrium-hidridet, nátrium-borohidridot és lítium-alumínium-hidridet.
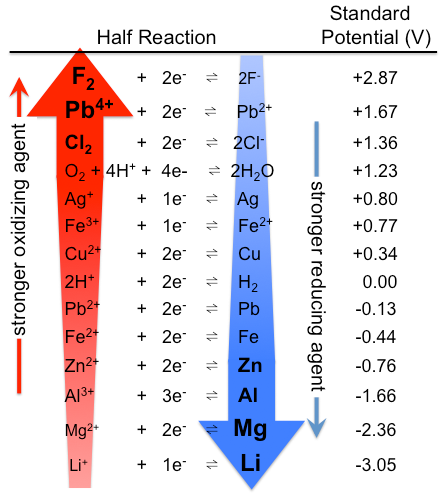
ábra \(\PageIndex{1}\): Standard elektródpotenciálok táblázata. Vegye figyelembe, hogy a rangsor itt az ellenkezője, erős oxidálószerekkel a tetején, erős redukálószerekkel az alján, mint a \(\PageIndex{1}\) táblázatban. A tényleges standard potenciál természetesen ugyanaz. (CC BY-SA 3.0; Tem5psu).
Hasonlóképpen, a \(\PageIndex{1}\) táblázatban szereplő összes faj, amely a H2 felett fekszik, erősebb reduktáns, mint a H2, és azok, amelyek a H2 alatt fekszenek, gyengébbek. A táblázatban a legerősebb reduktáns tehát fémes lítium, standard elektródpotenciálja -3, 04 V. Ez a tény meglepő lehet, mivel a cézium, nem a lítium, a legkevésbé elektronegatív elem. A látszólagos anomália azzal magyarázható, hogy az elektródpotenciálokat vizes oldatban mérik, ahol az intermolekuláris kölcsönhatások fontosak, míg az ionizációs potenciálokat és az elektron affinitásokat a gázfázisban mérik. Kis mérete miatt a Li+ ion vizes oldatban stabilizálódik erős elektrosztatikus kölcsönhatásokkal a vízmolekulák negatív dipól végével. Ezek a kölcsönhatások a Li + esetében szignifikánsan nagyobb Δhhidratációt eredményeznek a Cs + – hoz képest. A lítium-fém ezért az alkálifémek legerősebb redukálószere (legkönnyebben oxidált) vizes oldatban.
a standard redukciós potenciálok az anyagok oxidáló és redukáló erejük szerinti rangsorolásaként értelmezhetők. A H2 felett elhelyezkedő \(\PageIndex{1}\) táblázatban szereplő fajok erősebb redukálószerek (könnyebben oxidálódnak), mint a H2. A H2 alatt fekvő Fajok erősebb oxidálószerek.
mivel a \(\PageIndex{1}\) táblázatban látható félreakciók E°-értékük szerint vannak elrendezve, a táblázat segítségével gyorsan megjósolhatjuk a különböző oxidánsok és reduktánsok relatív erősségeit. A félreakció bal oldalán lévő bármely faj spontán oxidálja a másik félreakció jobb oldalán lévő fajokat, amelyek alatta helyezkednek el a táblázatban. Ezzel szemben a félreakció jobb oldalán lévő bármely faj spontán módon csökkenti a másik félreakció bal oldalán lévő fajokat, amelyek fölött a táblázatban találhatók. Ezeket az általánosításokat felhasználhatjuk a redox reakciók széles skálájának spontaneitásának előrejelzésére (E°cella > 0), amint azt a \(\PageIndex{1}\) példában szemléltetjük.
Például a \(\PageIndex{1}\): Ezüst-Szulfid
A fekete elhomályosítani, hogy űrlapok ezüst tárgyak elsősorban Ag2S. A fél-reakció a hátrameneti az, hogy lerombolja a folyamat a következőképpen:
- hivatkozva táblázat \(\PageIndex{1}\), megjósolni, hogy mely fajok—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—csökkentheti Ag2S Ag standard körülmények között.
- e fajok közül-H2O2(aq), Zn(s), I−(aq), Sn2+(AQ), meghatározza, hogy melyik a legerősebb redukálószer vizes oldatban, így a legjobb jelölt egy kereskedelmi termékre.
- a \(\PageIndex{1}\) táblázatban szereplő adatokból javasoljon egy alternatív redukálószert, amely könnyen elérhető, olcsó, és esetleg hatékonyabb a folt eltávolításában.
Adott: csökkentés fél-reakció standard elektród potenciál, valamint egy listát a lehetséges reductants
Kért: reductants a Ag2S, legerősebb reductant, illetve potenciális redukáló anyag eltávolítása elhomályosítani
Stratégia:
A helyüket a Táblázat a \(\PageIndex{1}\) döntse el, hogy melyik faj lehet csökkenteni Ag2S. Meghatározza, hogy mely faj a legerősebb reductant.
B használja a \(\PageIndex{1}\) táblázatot az Ag2S reduktánsának azonosításához, amely egy közös háztartási termék.
megoldás
a problémát kétféleképpen oldhatjuk meg: (1) hasonlítsa össze a négy lehetséges reduktáns relatív helyzetét az Ag2S/Ag páréval a \táblázatban (\PageIndex{1}\) vagy (2) hasonlítsa össze az E° – ot minden faj esetében az E° – val Az Ag2S/Ag pár esetében (-0.69 V).
- a A \(\PageIndex{1}\) táblázatban szereplő fajok felülről lefelé vannak elrendezve a redukáló erő növelése érdekében. A szóban forgó négy faj közül az I – (aq), az Sn2+(AQ) és a H2O2 (aq) az Ag2S felett helyezkedik el, az egyik pedig alatta. Ezért arra a következtetésre juthatunk,hogy a Zn(k) normál körülmények között csökkenthetik az Ag2S(K) et, míg az I−(aq), az Sn2+(AQ) és a H2O2 (aq) nem. Az Sn2+(AQ) és a H2O2(aq) kétszer jelenik meg a táblázatban: a bal oldalon (oxidálószer) az egyik félreakcióban, a jobb oldalon (reduktáns) a másikban.
- a legerősebb reduktáns a Zn (k), a Félreakció jobb oldalán lévő faj, amely közelebb áll a \(\PageIndex{1}\) táblázat aljához, mint az I-(aq), Sn2+(aq) és H2O2 (aq) félreakciók. (A cinkdarabot használó kereskedelmi termékeket gyakran “csoda termékként” forgalmazzák az ezüstből származó kátrány eltávolítására. Mindössze annyit kell tennie, hogy meleg vizet és sót adjon az elektromos vezetőképességhez.)
- a \(\PageIndex{1}\) táblázatban a Zn (k) alatt fekvő reduktánsok, ezért erősebb reduktánsok, csak egy általánosan elérhető háztartási termékekben: Al (k), amelyet alumíniumfóliaként értékesítenek élelmiszerek csomagolására.
példa \ (\PageIndex{2}\):
A Táblázatban az adatok \(\PageIndex{1}\), hogy megállapítsa, hogy minden reakció valószínű spontán normál körülmények:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Lehet(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Adott: redox reakció listája standard elektróda potenciálok (Táblázat P2 )
Kért: reakció spontán
Stratégia:
- Azonosítani a fél-reakciók az egyes egyenlet. A \(\PageIndex{1}\) táblázat segítségével határozza meg a félreakciók standard potenciálját a megfelelő irányba.
- használja a \(e_{cell}=e^o_{srp}(katód) – E^o_{srp}(anód)\) egyenletet az általános reakció standard cellapotenciáljának kiszámításához. Ebből az értékből határozza meg, hogy a teljes reakció spontán-e.
- egy fémes ón Sn2+(AQ) – ra oxidálódik, a Be2+(AQ) pedig elemi berilliumra redukálódik. Az utóbbi (redukciós) félreakció (-1) standard elektródpotenciáljait találjuk.85 V) és az előbbi (oxidációs) félreakció (-0,14 V) esetében közvetlenül a \(\PageIndex{1}\) táblázatból .
B A két félreakció hozzáadása adja a teljes reakciót:
|
\(\textrm{cathode:} \; \mathrm{be^{2+}(AQ)} +\mathrm{2e^ -} \rightarrow \mathrm{be(s)}\) \(\textrm{Anode:} \; \mathrm{SN(s) \rightarrow \mathrm{SN^{2+}}}} (s)} +\mathrm{2E^ -}\) \(\textrm{összesen:} \; \mathrm{Sn(s)+ \mathrm{be^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}} (AQ)} + \mathrm{Be(s)}\) |
\(e^\circ_{\textrm{cathode}}}=\textrm{-1.99 v} \ \ \e^\circ_ {\textrm{anode}}}= \ textrm{-0.14 v} \ \e^\Circ_ {\textrm{cell}}}=e^\circ_ {\textrm{cathode}}}-e^\circ_ {\textrm{Anode}} \ \\hspace{5mm} =- \textrm{1.85 v}\) |
a standard cellapotenciál meglehetősen negatív, így a reakció nem fordul elő spontán módon, ahogy írták. Ez azt jelenti, hogy a fém ón szabványos körülmények között nem csökkentheti a Be2+ – ot berillium fémre. Ehelyett a fordított folyamat, a sztannosionok (Sn2+) csökkentése fémes berilliummal, amelynek pozitív értéke E°cella, spontán módon történik.
- a MnO2 az oxidálószer (Mn4+ Mn2+− ra redukálódik), míg H2O2 a reduktáns (O2-oxidálódik O2-re). A redukciós és oxidációs félreakciókra vonatkozó standard elektródpotenciálokat közvetlenül a \(\PageIndex{1}\) táblázatból kaphatjuk meg .
B A két félreakció és azok megfelelő potenciálja a következő:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ e^\circ_{\textrm{anode}}=\textrm{0.70 V} \\ e^\circ_{\textrm{cell}}}=e^\circ_{\textrm{cathode}}-e^\circ_{\textrm{anode}} \ \ \hspace{5mm} =- \textrm{0.53 v}\) |
a reakció standard potenciálja pozitív, jelezve, hogy normál körülmények között spontán módon történik, ahogy írták. A hidrogén-peroxid csökkenti az MnO2-t, az oxigéngáz pedig az oldatból fejlődik ki.
Exercise \(\PageIndex{2}\)
használja az adatokat a táblázat \(\PageIndex{1}\) annak meghatározására, hogy minden reakció valószínűleg spontán módon fordul elő normál körülmények között:
- 2ce4+(aq) + 2cl−(aq) → 2ce3+(aq) + Cl2(G)
- 4mno2(s) + 3O2(g) + 4OH−(AQ) → 4mno4−(AQ) + 2H2O
válasz
- spontán (E°Cell = 0,36 v)
- nemszpontán (e°cell = -0.20 V)
bár az E°cella jele azt jelzi, hogy egy adott redox reakció spontán módon történik-e normál körülmények között, nem mondja meg, hogy a reakció milyen mértékben folytatódik, és nem mondja meg, mi fog történni nem szabványos körülmények között. E kérdések megválaszolásához az elektrokémiai sejtpotenciál és a kémiai termodinamika közötti összefüggés kvantitatívabb megértése szükséges.
összefoglaló
a különböző oxidálószerek és reduktánsok relatív erősségei e° – értékek alapján előre jelezhetők. A különböző anyagok oxidatív és reduktív erősségeit standard elektródpotenciálokkal lehet összehasonlítani. A látszólagos anomáliák azzal magyarázhatók, hogy az elektródpotenciálokat vizes oldatban mérik, ami erős intermolekuláris elektrosztatikus kölcsönhatásokat tesz lehetővé, nem pedig a gázfázisban.
koncepcionális problémák
- az elektródpotenciálok sorrendjét nem mindig lehet előre jelezni ionizációs potenciálokkal és elektron affinitásokkal. Miért? Elvárja, hogy a nátrium-fémnek nagyobb vagy alacsonyabb elektródpotenciálja legyen, mint az ionizációs potenciáljából várható? Mi a hozzávetőleges elektródpotenciál?
- a br2/Br−, Ca2+/Ca, O2/OH− és Al3+/Al táblázatos adatokra való hivatkozás nélkül, melyek a legkevésbé negatív elektródpotenciálúak, és melyek a leginkább negatívak? Miért?
- a tojásfehérjében jelen lévő kéntartalmú aminosavak miatt az ezüst villával történő tojásfogyasztás elrontja a villát. Kémikusként mindenféle érdekes tisztítószer van a szekrényben, beleértve egy 1 M-es oxálsav oldatot (H2C2O4). Ezt a megoldást választaná, hogy megtisztítsa a villát, amelyet elrontott a rántotta evéséből?
- a Cu2+(aq) + 2e− → CU(s) reakció elektródpotenciálja normál körülmények között 0,34 V. A Cu 0,5 mol oxidációjának potenciálja -0,34/2 V? Magyarázza el a választ.
- olvassa el a \(\PageIndex{1}\) táblázatot, hogy megjósolja
- melyik faj—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) és/vagy H2O2(aq)—oxidálhatja az MnO2(k)− t MNO4-re-normál körülmények között.
- mely fajok—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) és/vagy H2O2(aq)—a legerősebb oxidálószer vizes oldatban.
fogalmi válasz
- nem; E° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply