Sammenligne Styrker Av Oksidanter og Reduktanter
Læringsmål
- Identifiser Hvordan du viser Standard Reduksjonspotensialer fra perspektivet av levedyktige reduksjonsmidler og oksidasjonsmidler i REDOKSREAKSJONER.
vi kan måle standardpotensialene for et bredt spekter av kjemiske stoffer, hvorav noen er oppført I Tabell P2. Disse dataene tillater oss å sammenligne oksidative og reduktive styrker av en rekke stoffer. Halvreaksjonen for standard hydrogenelektroden (SHE) ligger mer enn halvveis ned i listen I Tabell \(\PageIndex{1}\). Alle reaktanter som ligger under SHE i tabellen er sterkere oksidanter Enn H+, og alle de som ligger over SHE er svakere. Den sterkeste oksidanten i tabellen Er F2, med et standard elektrodepotensial på 2,87 V. denne høye verdien er i samsvar med fluorets høye elektronegativitet og forteller oss at fluor har en sterkere tendens til å akseptere elektroner (det er en sterkere oksidant) enn noe annet element.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 | F2(g) + 2e−\(\høyreftspiseskjeer\) 2F−(aq) | 2,87 |
ikke alle oksidasjonsmidler og reduksjonsmidler er skapt like. Standard reduksjonspotensialene I Tabell \(\PageIndex{1}\) kan tolkes som en rangering av stoffer i henhold til deres oksiderende og reduserende kraft. Sterke oksidasjonsmidler er vanligvis forbindelser med elementer i høye oksidasjonstilstander eller med høy elektronegativitet, som får elektroner i redoksreaksjonen (Figur \(\PageIndex{1}\)). Eksempler på sterke oksidasjonsmidler inkluderer hydrogenperoksid, permanganat og osmiumtetroksid. Reduksjonsmidler er typisk elektropositive elementer som hydrogen, litium, natrium, jern og aluminium, som mister elektroner i redoksreaksjoner. Hydrider (forbindelser som inneholder hydrogen i formell -1 oksidasjonstilstand), som natriumhydrid, natriumborhydrid og litiumaluminiumhydrid, brukes ofte som reduksjonsmidler i organiske og organometalliske reaksjoner.
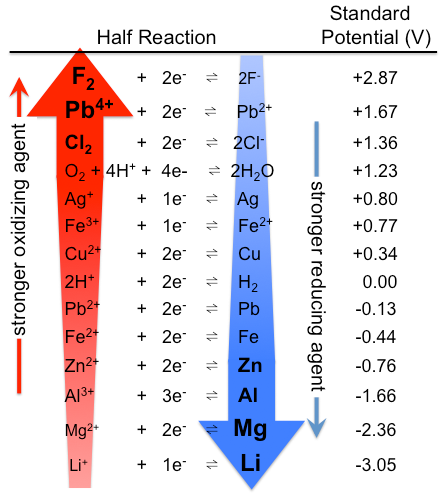
Figur \(\PageIndex{1}\): Tabell med standard elektrodepotensialer. Merk at rangeringen er motsatt her, med sterke oksidasjonsmidler øverst og sterke reduksjonsmidler nederst, enn I Tabell \(\PageIndex{1}\). De faktiske standard potensialene er de samme selvfølgelig. (CC BY-SA 3.0; Tem5psu).På Samme måte er alle arter I Tabell \(\PageIndex{1}\) som ligger over H2 sterkere reduktanter Enn H2, og de som ligger under H2 er svakere. Det sterkeste reduksjonsmiddelet i tabellen er således metallisk litium, med et standard elektrodepotensial på -3,04 V. Dette faktum kan være overraskende fordi cesium, ikke litium, er det minst elektronegative elementet. Den tilsynelatende anomali kan forklares ved at elektrodepotensialer måles i vandig løsning, hvor intermolekylære interaksjoner er viktige, mens ioniseringspotensialer og elektronaffiniteter måles i gassfasen. På grunn Av sin lille størrelse stabiliseres Li+ – ion i vandig oppløsning ved sterke elektrostatiske interaksjoner med den negative dipolenden av vannmolekyler. Disse interaksjonene resulterer i en signifikant større Hryvhhydrering For Li+sammenlignet med Cs+. Litiummetall er derfor det sterkeste reduksjonsmiddelet (lettest oksidert) av alkalimetallene i vandig løsning.
standard reduksjonspotensialene kan tolkes som en rangering av stoffer i henhold til deres oksiderende og reduserende kraft. Arter I Tabell \(\PageIndex{1}\) som ligger over H2 er sterkere reduksjonsmidler (lettere oksidert) Enn H2. Arter som ligger under H2 er sterkere oksidasjonsmidler.
fordi halvreaksjonene som vises I Tabellen \(\PageIndex{1}\) er ordnet etter Deres e°-verdier, kan vi bruke tabellen til raskt å forutsi den relative styrken til forskjellige oksidanter og reduktanter. Enhver art på venstre side av en halvreaksjon vil spontant oksidere enhver art på høyre side av en annen halvreaksjon som ligger under den i tabellen. Omvendt vil enhver art på høyre side av en halvreaksjon spontant redusere noen arter på venstre side av en annen halvreaksjon som ligger over den i tabellen. Vi kan bruke disse generaliseringene til å forutsi spontaniteten til et bredt spekter av redoksreaksjoner (e°celle > 0), som illustrert I Eksempel \(\PageIndex{1}\).
Eksempel \(\PageIndex{1}\): Sølvsulfid
den svarte anløpe som dannes på sølvobjekter er primært Ag2S. halvreaksjonen for å reversere anløpe prosessen er som følger:
- Refererer Til Tabell \(\PageIndex{1}\), forutsi hvilke arter—H2O2(aq), Zn(s), i−(aq), Sn2+(Aq)—kan redusere Ag2S Til Ag under standardbetingelser.AV disse artene—H2O2 (aq), Zn (s), I−(aq), Sn2+(aq), identifiserer som er det sterkeste reduksjonsmiddelet i vandig oppløsning og dermed den beste kandidaten for et kommersielt produkt.
- fra dataene I Tabellen \(\PageIndex{1}\), foreslå et alternativt reduksjonsmiddel som er lett tilgjengelig, billig og muligens mer effektivt for å fjerne tarnish.

Gitt: reduksjon halvreaksjon, standard elektrode potensial, og liste over mulige reduktanter
Bedt om: reduktanter For Ag2S, sterkeste reduktant, og potensielle reduksjonsmiddel for å fjerne anløpe
Strategi:
A fra sine posisjoner I Tabellen \(\PageIndex{1}\), bestemme hvilke arter kan redusere Ag2S. Bestemme hvilken art er den sterkeste reduktant.
B Bruk Tabell \(\PageIndex{1}\) for å identifisere et reduktant For Ag2S som er et vanlig husholdningsprodukt.
Løsning
Vi kan løse problemet på en av to måter: (1) sammenlign de relative posisjonene til De fire mulige reduksjonsmidlene med Ag2S / Ag-paret I Tabellen \(\PageIndex{1}\) eller (2) sammenlign e° for hver art Med E° For Ag2S/Ag-paret (-0.69 V).
- a arten I Tabell \(\PageIndex{1}\) er ordnet fra topp til bunn for å øke reduksjonsstyrken. Av de fire artene som er gitt i problemet, ligger I−(aq), Sn2+(aq) og H2O2(aq) over Ag2S, og en ligger under Den. Vi kan derfor konkludere med At Zn (s) kan redusere Ag2S (s) under standardbetingelser, mens I−(aq), Sn2 + (aq) og H2O2(aq) ikke kan. Sn2+(aq) og H2O2(aq) vises to ganger i tabellen: på venstre side (oksidant) i en halvreaksjon og på høyre side (reduktant) i en annen.
- den sterkeste reduktanten Er Zn(s), arten på høyre side av halvreaksjonen som ligger nærmere bunnen Av Tabellen \(\PageIndex{1}\) enn halvreaksjonene som involverer I-(aq), Sn2+(aq) og H2O2(Aq). (Kommersielle produkter som bruker et stykke sink blir ofte markedsført som et «mirakelprodukt» for å fjerne tarnish fra sølv. Alt som kreves er å legge til varmt vann og salt for elektrisk ledningsevne.)
- B av reduktantene som ligger under Zn (s) I Tabell \(\PageIndex{1}\), og derfor er sterkere reduktanter, er bare en vanlig tilgjengelig i husholdningsprodukter: Al(s), som selges som aluminiumsfolie for innpakning av matvarer.
Eksempel \(\PageIndex{2}\):
Bruk Dataene I Tabellen \(\PageIndex{1}\) for å avgjøre om hver reaksjon sannsynligvis vil oppstå spontant under standardbetingelser:
- sn(s) + Be2+(aq) → Sn2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2h+(aq) → o2(g) + mn2+(Aq) + 2h2o(l)
gitt: redoksreaksjon og liste over standard elektrodepotensialer (tabell p2)
bedt om: reaksjons spontanitet
strategi:
- Identifiser halvreaksjonene I HVER LIGNING. Bruk Tabell \(\PageIndex{1}\), bestem standardpotensialene for halvreaksjonene i riktig retning.
- Bruk \(E_{cell}=E^o_{srp}(katode) – e^o_{srp}(anode)\) ligningen for å beregne standardcellepotensialet for den totale reaksjonen. Fra denne verdien bestemmer du om den totale reaksjonen er spontan.
Løsning
- En Metallisk tinn oksyderes Til Sn2+(aq), Og Be2 + (aq) reduseres til elementær beryllium. Vi kan finne standard elektrodepotensialene for sistnevnte (reduksjon) halvreaksjon (-1.85 V) og for den tidligere (oksidasjon) halvreaksjonen (-0.14 V) direkte Fra Tabell \(\PageIndex{1}\) .
B Å Legge til de to halvreaksjonene gir den totale reaksjonen:
|
\(\textrm{katode:} \; \mathrm{Være^{2+}(aq)} +\mathrm{2e^ -} \rightarrow \mathrm{be(s)}\) \(\textrm{anode:} \; \mathrm{sn(s) \rightarrow \mathrm{sn^{2+}}(s)} +\mathrm{2e^ -}\) \(\textrm{total:} \; \mathrm{Sn(s)+ \mathrm{Være^{2+}(aq)} \rightarrow \mathrm{sn^{2+}}(aq)} + \mathrm{være(s)}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{-1.99 V} \\ e^\circ_{\textrm{anode}}=\textrm{-0.14 v} \\ e^\Circ_{\textrm{cell}}=e^\circ_{\textrm{katode}}-e^\circ_{\textrm{Anode}} \\ \hspace{5mm} =-\textrm{1.85 v}\) |
standardcellepotensialet er ganske negativt, så reaksjonen vil ikke oppstå spontant som skrevet. Det vil si at metallisk tinn ikke kan redusere Be2+ til berylliummetall under standardbetingelser. I stedet vil omvendt prosess, reduksjon av stannøse ioner (Sn2+) av metallisk beryllium, som har en positiv verdi Av E°celle, skje spontant.
- A MnO2 er oksidanten (Mn4+ er redusert Til Mn2+), MENS H2O2 er reduktanten (O2− oksideres Til O2). Vi kan få standard elektrode potensialer for reduksjon og oksidasjon halv-reaksjoner direkte Fra Tabell \(\PageIndex{1}\) .
B de to halvreaksjonene og deres tilsvarende potensialer er som følger:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ e^\circ_{\textrm{anode}}=\textrm{0.70 V} \\ e^\circ_{\textrm{cell}}=E^\circ_{\textrm{katode}}-E^\circ_{\textrm{anode}} \ \ hspace{5mm} =- \textrm{0.53 v}\) |
standardpotensialet for Reaksjonen er positivt, noe som indikerer at det under standardbetingelser vil oppstå spontant som skrevet. Hydrogenperoksid vil redusere MnO2, og oksygengass vil utvikle seg fra løsningen.
Øvelse \(\PageIndex{2}\)
Bruk dataene I Tabellen \(\PageIndex{1}\) For å avgjøre om hver reaksjon sannsynligvis vil oppstå spontant under standardbetingelser:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4mno2(s) + 3o2(g) + 4oh−(aq) → 4mno4−(Aq) + 2h2o
Svar
- spontan (e°celle = 0.36 v)
- nonspontan (e°celle = -0.20 V)
selv om tegnet På e°celle forteller oss om en bestemt redoksreaksjon vil oppstå spontant under standardbetingelser, forteller det oss ikke i hvilken grad reaksjonen fortsetter, og det forteller oss ikke hva som vil skje under ikke-standardiserte forhold. For å svare på disse spørsmålene krever en mer kvantitativ forståelse av forholdet mellom elektrokjemisk cellepotensial og kjemisk termodynamikk.
Oppsummering
den relative styrken til forskjellige oksidanter og reduktanter kan forutsies Ved Bruk Av e° – verdier. De oksidative og reduktive styrkene til en rekke stoffer kan sammenlignes ved hjelp av standard elektrodepotensialer. Tilsynelatende anomalier kan forklares ved at elektrodepotensialer måles i vandig løsning, noe som muliggjør sterke intermolekylære elektrostatiske interaksjoner, og ikke i gassfasen.
Konseptuelle Problemer
- rekkefølgen av elektrodepotensialer kan ikke alltid forutsies av ioniseringspotensialer og elektronaffiniteter. Hvorfor? Forventer du at natriummetall har et høyere eller lavere elektrodepotensial enn forutsatt fra ioniseringspotensialet? Hva er dens omtrentlige elektrodepotensial?
- Uten å referere Til tabulerte data, av Br2 / Br -, Ca2 + / Ca, O2 / OH – Og Al3+ / Al, som ville du forvente å ha minst negativ elektrode potensial og som den mest negative? Hvorfor?
- På grunn av de svovelholdige aminosyrene som er tilstede i hvite hvitt, vil det å spise egg med en sølvgaffel ødelegge gaffelen. Som kjemiker har du alle slags interessante rengjøringsprodukter i skapet ditt, inkludert en 1 M løsning av oksalsyre (H2C2O4). Vil du velge denne løsningen for å rengjøre gaffelen som du har tarnished fra å spise eggerøre?
- elektrodepotensialet For Reaksjonen Cu2+(aq) + 2e – → Cu (s) er 0,34 V under standardbetingelser. Er potensialet for oksidasjon av 0,5 mol Cu lik -0,34 / 2 v? Forklar svaret ditt.
- Se Tabell \(\PageIndex{1}\) for å forutsi
- hvilke arter—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) og/ELLER H2O2(aq)—kan oksidere MnO2(s) TIL MNO4− under standardbetingelser.
- Hvilke arter—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3 + (aq) og / ELLER H2O2 (aq)—er det sterkeste oksidasjonsmidlet i vandig oppløsning.
Konseptuelt Svar
- Nei; e° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply