비교의 장점을 산화제와 Reductants
학습 목표
- 는 방법을 확인하기준 감소 전위의 관점에서 실행 가능한 줄이고 산화제에서 산화환원 반응이다.
우리는 다양한 화학 물질에 대한 표준 전위를 측정 할 수 있으며 그 중 일부는 표 P2 에 나와 있습니다. 이러한 데이터를 통해 다양한 물질의 산화 및 환원 강점을 비교할 수 있습니다. 표준 수소 전극(SHE)에 대한 반 반응은 표\(\PageIndex{1}\)의 목록 중간 이상에있다. 테이블에있는 그녀 아래에 놓인 모든 반응물은 H+보다 강한 산화제이며,그녀 위에 놓인 모든 것들은 약합니다. 강한 산화제에서 테이블 F2,표준 전극의 잠재적인 2.87V. 이 높은 값이 일관성과 높은 전기 음성의 불소고 우리에게는 불소는 강력한 경향을 받아 전자는(그것은 강한 산화제)보다 다른 어떤 요소입니다.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g)+2e−\(\rightleftharpoons\)2−(aq) | 2.87 |
하지 않는 모든 산화제와 흡진기는 동등하게 창조되었습니다. 표\(\PageIndex{1}\)의 표준 환원 전위는 산화 및 환원력에 따라 물질의 순위로 해석 될 수 있습니다. 강한 산화 에이전트는 일반적으로 화합물 요소에서 높은 산화 상태 또는 높은 전기 음성있는 전자서 산화환원 반응(그림\(\PageIndex{1}\)). 강한 산화제의 예로는 과산화수소,과망간산 염 및 오스뮴 테트록 시드가 있습니다. 감소시키는 대리인은 일반적으로 전기 양성 요소와 같은 수소,리튬,나트륨,철,알루미늄 잃고,전자에서 산화환원 반응이다. Hydrides(을 포함하는 화합물에서 수소의 공식적인 -1 산화 상태)와 같은 수소 나트륨,나트륨 보로와 리튬 알루미늄 수소화물,종종 사용으로 감소시키는 대리인에서는 유기 및 유기금속반응.
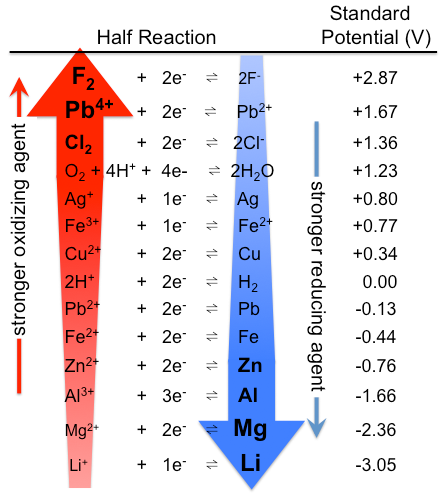
그림\(\pageindex{1}\):표준 전극 전위의 표. 표\(\PageIndex{1}\)보다 상단에 강한 산화제가 있고 하단에 강한 환원제가있는 순위는 여기에서 반대입니다. 실제 표준 전위는 물론 동일합니다. (CC BY-SA3.0;Tem5psu).
유사하게,H2 위에 놓인 표\(\PageIndex{1}\)의 모든 종은 H2 보다 더 강한 환원제이며,H2 아래에 놓인 종은 더 약하다. 강력한 환원제 표에 따라서 금속 리튬,표준 전극의 잠재력을 -3.04V. 이 사실은 놀라운 일이 될 수도 있습니다 때문에 세슘,지 리튬,은 적어도 음성 요소입니다. 명백한 이상에 의해 설명할 수 있다는 사실 전극 잠재력에서 측정된 수용액,는 분자간 상호 작용이 중요한 반면,이온화 잠재력과 전자 선호도에서 측정된 가스 단계입니다. 때문에 작은 크기,리+이온은 안정된 수용액에 의해 강력한 정전기와의 상호 작용하는 부정적인 쌍극자 끝의 물 분자. 이러한 상호 작용은 Cs+와 비교하여 Li+에 대해 유의하게 더 큰 ΔHhydration 을 초래한다. 따라서 리튬 금속은 수용액에서 알칼리 금속 중 가장 강한 환원제(가장 쉽게 산화 됨)입니다.
표준 감소 잠재력으로 해석될 수 있는 물질의 순위에 따라 산화 및 환원력. H2 위에 놓인 표\(\PageIndex{1}\)의 종은 H2 보다 더 강한 환원제(더 쉽게 산화 됨)입니다. H2 아래에 놓인 종은 더 강한 산화제입니다.
기 때문에 반 반응 표\(\PageIndex{1}\)배치하기 위해서는 그들의 전자°값을,우리가 사용할 수 있는 테이블에 신속하게 예측하고 상대적 강점의 다양한 산화제와 reductants. 어떤 종류의 왼쪽에서 반응이 자발적으로 산화하는 모든 종의 오른쪽에 다른 반응이에있는 아래에 테이블에 있습니다. 반대로,어떤 종류의 오른쪽에 반응할 것이 자발적으로 줄이 어떤 종류의 왼쪽에서 다른 반응이 거짓말을 그 위에 테이블에 있습니다. 우리는 이러한 사용할 수 있습니다 일반화를 예측하고 자연스러움의 다양한 산화 환원 반응(E°셀>0)에 도시 된 바와 같이,예\(\PageIndex{1}\).
예\(\PageIndex{1}\):은 황화
블랙 손상시키는 양식에서 은 개체는 주로 Ag2S. 반반응에 대한 반전을 손상시키는 과정은 다음과 같습니다:
- 을 참조하면 테이블\(\PageIndex{1}\),예측되는 종 H2O2(aq),아연(s),I(aq),Sn2+(aq)—을 줄일 수 있습 Ag2S 을 Ag 표준 조건 하에서.
- 의 이종—H2O2(aq),아연(s),I(aq),Sn2+(aq),를 식별하는 강력한 감소시키는 대리인에서 수용액고,따라서 최상의 후보에 대한 상업적인 제품입니다.
- 표\(\PageIndex{1}\)의 데이터에서 쉽게 사용할 수 있고 저렴하며 변색을 제거하는 데 더 효과적인 대체 환원제를 제안하십시오.

어:감소 반응,전극을 표준 잠재력과 가능한 reductants
요:reductants 에 대한 Ag2S,강한 reductant,그리고 잠재적인 감소를 제거하기 위해 에이전트를 손상시키
전략:
에서 자신의 위치를 표\(\PageIndex{1}\),결정하는 종을 줄일 수 있습 Ag2S. 결정하는 종은 가장 강력한 reductant.
B 일반적인 가정용 제품인 Ag2S 의 환원제를 식별하려면 Table\(\PageIndex{1}\)를 사용하십시오.
솔루션
우리는 문제를 해결할 수 있는 두 가지 방법 중 하나: (1)비교하면 상대적 위치의 네 가 reductants 의 Ag2S/Ag 에서 부부 테이블\(\PageIndex{1}\)또는(2)비교 전자°에 대한 각종 전자°에 대한 Ag2S/Ag 몇(-0.69V).
- A 표\(\PageIndex{1}\)의 종은 감소 강도를 증가시키는 순서로 위에서 아래로 배열됩니다. 문제에 주어진 4 종 중 I-(aq),Sn2+(aq)및 H2O2(aq)는 Ag2S 위에 놓여 있으며 하나는 그 아래에 놓여 있습니다. 따라서 zn(s)은 표준 조건에서 Ag2S(s)를 줄일 수 있지만 I−(aq),Sn2+(aq)및 H2O2(aq)는 줄일 수 없다고 결론 내릴 수 있습니다. Sn2+(aq)와 H2O2(aq)는 표에 두 번 나타납니다:한쪽 반 반응에서 왼쪽(산화제)과 다른 쪽(환원제)에서 오른쪽(환원제).
- 강력한 환원제가 Zn(s),종들의 오른쪽에 반응 속이는 바닥에 가까운 테이블의\(\PageIndex{1}\)보다 절반-포함하는 반응 I−(aq),Sn2+(aq),H2O2(aq). (아연 조각을 사용하는 상용 제품은 종종은에서 변색을 제거하기위한”기적의 제품”으로 판매됩니다. 필요한 것은 전기 전도성을 위해 따뜻한 물이나 소금을 첨가하는 것뿐입니다.)
- B 의 reductants 는 거짓말은 아래 Zn(s)에서 테이블\(\PageIndex{1}\),따라서 강한 reductants,하나는 일반적으로 사용 가능한 가정용 제품:Al(s),이는 판매를 위한 알루미늄 호일 포장 음식입니다.예를 들어 페이지 인덱스{2}\):
데이터를 사용하여 표\(\PageIndex{1}\)지 여부를 확인하는 각 반응은 발생할 가능성이 자발적으로 표준 조건 하에서:
- Sn(s)+Be2+(aq)→Sn2+(aq)+것(s)
- MnO2(s)+H2O2(aq)+2H+(aq) →O2(g)+Mn2+(aq)+2H2O(l)
정:산화 환원 반응 목록의 표준 전극 잠재력을(표 P2)
요:반응 자연스러움
전략:
- 식별 반 반응에서 각 방정식이다. 표\(\PageIndex{1}\)를 사용하여 반 반응에 대한 표준 전위를 적절한 방향으로 결정하십시오.
- 사용\(E_{셀}=E^o_{srp}(음극)-E^o_{srp}(양극)\)방정식을 계산하는 표준 휴 잠재력에 대한 전반적인 반응입니다. 이 값으로부터 전반적인 반응이 자발적인지 여부를 결정하십시오.
용액
- 금속 주석은 Sn2+(aq)로 산화되고 Be2+(aq)는 원소 베릴륨으로 환원된다. 우리는 후자의(감소)반 반응에 대한 표준 전극 전위를 찾을 수 있습니다(-1.85V)및 표\(\PageIndex{1}\)에서 직접 전(산화)반 반응(-0.14V)에 대해.
B 추가 두 개의 절반의 반응은 전체적인 반응:
\(\textrm{음극선:}\;\mathrm{수^{2+}(aq)}+\mathrm{2e^-} \rightarrow\mathrm{것(s)}\)
\(\textrm{양극:}\;\mathrm{Sn(s)\rightarrow\mathrm{Sn^{2+}}(s)}+\mathrm{2e^-}\)
\(\textrm{총:} \; \mathrm{Sn(s)+\mathrm{수^{2+}(aq)}\rightarrow\mathrm{Sn^{2+}}(aq)}+\mathrm{것(s)}\)
\(E^\circ_{\textrm{음극}}=\textrm{-1.99V}\\E^\circ_{\textrm{양극}}=\textrm{-0.14V} \\E^\circ_{\textrm{셀}}=E^\circ_{\textrm{음극}}-E^\circ_{\textrm{양극}}\\\hspace{5mm}=-\textrm{1.85V}\) 표준 셀 잠재력이 매우 매력적이고,따라서 반응이 발생하지 않을 것이 자발적으로 기록됩니다. 즉,금속 주석은 표준 조건 하에서 be2+를 베릴륨 금속으로 감소시킬 수 없다. 대신에,역방향 프로세스의 감소 stannous 이온(Sn2+)의 금속 베릴륨,는 긍정적인 값 E°셀,이 자발적으로 발생.
- A MnO2 는 산화제(Mn4+는 Mn2+로 환원 됨)이고 H2O2 는 환원제(O2−는 O2 로 산화 됨)입니다. 표\(\PageIndex{1}\)에서 직접 환원 및 산화 반 반응에 대한 표준 전극 전위를 얻을 수 있습니다.
B 두 가지 반 반응과 그에 상응하는 전위는 다음과 같습니다:
\(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} &
\mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} &
\mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\)\(E^\circ_{\textrm{cathode}}=\textrm{1.22V}\\E^\circ_{\textrm{양극}}=\textrm{0.70V}\\E^\circ_{\textrm{셀}}=E^\circ_{\textrm{음극}}-E^\circ_{\textrm{양극}}\\\hspace{5mm}=-\textrm{0.53V}\) 표준에 대한 잠재적인 반응은 긍정적인을 나타내는 표준 조건 하에서,그것이 발생할 것이 자발적으로 기록됩니다. 과산화수소는 MnO2 를 감소시키고 산소 가스는 용액에서 진화 할 것입니다.
운동\(\PageIndex{2}\)
데이터를 사용하여 표\(\PageIndex{1}\)지 여부를 확인하는 각 반응은 발생할 가능성이 자발적으로 표준 조건 하에서:
- 2Ce4+(aq)+2Cl−(aq)→2Ce3+(aq)+Cl2(g)
- 4MnO2(s)+3O2(g)+4OH−(aq)→4MnO4−(aq)+2H2O
대답
- 자발적인(전자°셀=0.36V)
- nonspontaneous(E°셀=-0.20V)
지만 등록하십시오 E°셀 여부와 상관없이 우리에게 특정 산화 환원 반응이 자발적으로 발생 표준 조건 하에서,그것은 저희에게 말하지 않는 어느 정도 반응이 진행되지 않습 우리에게 무슨 일이 일어날 것에 비표준 조건입니다. 이러한 질문에 대답이 필요하량 사이의 관계를 이해하는 전기화학 세포 및 잠재적인 화학열역학.
요약
다양한 산화제와 환원제의 상대 강도는 E°값을 사용하여 예측할 수 있습니다. 다양한 물질의 산화 및 환원 강도는 표준 전극 전위를 사용하여 비교할 수 있습니다. 분명 이상이 될 수 있다는 사실에 의해 설명 전극 잠재력에서 측정된 수용액,할 수 있는 강력한 정전기 분자간 상호작용,그리고 가스 단계입니다.
개념적 문제
- 의 순서로 전극 잠재력할 수 없습니에 의해 예측 이온화 및 잠재력 전자 친화력. 왜? 나트륨 금속이 이온화 전위에서 예측 한 것보다 높거나 낮은 전극 전위를 가질 것으로 기대합니까? 대략적인 전극 잠재력은 무엇입니까?
- 표로 작성된 데이터를 참조하지 않고 Br2/Br−,Ca2+/Ca,O2/OH−및 Al3+/Al 중 어느 것이 음극 전위가 가장 적고 어느 것이 가장 부정적입니까? 왜?
- 달걀 흰자위에 존재하는 황 함유 아미노산 때문에 은색 포크로 계란을 먹으면 포크가 더러워집니다. 화학자로서,당신은 옥살산(H2C2O4)의 1m 용액을 포함하여 캐비닛에 모든 종류의 흥미로운 청소 제품을 가지고 있습니다. 스크램블 드 에그를 먹으면서 변색 된 포크를 청소하려면이 솔루션을 선택 하시겠습니까?
- 반응 cu2+(aq)+2e−→Cu(s)에 대한 전극 전위는 표준 조건 하에서 0.34V 이다. 0.5mol 의 cu 의 산화 가능성은 -0.34/2V 와 같습니까? 당신의 대답을 설명하십시오.
- 테이블을 참조하십시오\(\PageIndex{1}\)예측하는
- 는 종 Sn4+(aq),Cl(aq),Ag+(aq),Cr3+(aq),및/또는 H2O2(aq)—산화할 수 있 MnO2(s)MNO4−이 있습니다
- 는 종 Sn4+(aq),Cl(aq),Ag+(aq),Cr3+(aq),및/또는 H2O2(aq)—강한 산화제에서는 수용성 솔루션입니다.
개념적 대답
- 아니오;E°=-0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply