Confronto delle forze di ossidanti e riduttanti
Obiettivi formativi
- Identificare come visualizzare i potenziali di riduzione standard dal punto di vista degli agenti riducenti e ossidanti vitali nelle reazioni REDOX.
Possiamo misurare i potenziali standard per un’ampia varietà di sostanze chimiche, alcune delle quali sono elencate nella Tabella P2. Questi dati ci consentono di confrontare i punti di forza ossidativi e riduttivi di una varietà di sostanze. La semireazione per l’elettrodo di idrogeno standard (SHE) si trova a più di metà dell’elenco nella tabella \(\PageIndex{1}\). Tutti i reagenti che si trovano sotto la SHE nella tabella sono ossidanti più forti di H+, e tutti quelli che si trovano sopra la SHE sono più deboli. L’ossidante più forte nella tabella è F2, con un potenziale elettrodo standard di 2,87 V. Questo alto valore è coerente con l’elevata elettronegatività del fluoro e ci dice che il fluoro ha una tendenza più forte ad accettare elettroni (è un ossidante più forte) rispetto a qualsiasi altro elemento.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
Non tutti gli ossidanti e riduttori sono creati uguali. I potenziali di riduzione standard nella Tabella \(\PageIndex{1}\) possono essere interpretati come una classifica delle sostanze in base al loro potere ossidante e riducente. Gli agenti ossidanti forti sono tipicamente composti con elementi in alti stati di ossidazione o con alta elettronegatività, che guadagnano elettroni nella reazione redox (Figura \(\PageIndex{1}\)). Esempi di forti ossidanti includono perossido di idrogeno, permanganato e tetrossido di osmio. Gli agenti riducenti sono tipicamente elementi elettropositivi come idrogeno, litio, sodio, ferro e alluminio, che perdono elettroni nelle reazioni redox. Gli idruri (composti che contengono idrogeno nello stato di ossidazione formale -1), come l’idruro di sodio, il boroidruro di sodio e l’idruro di alluminio di litio, sono spesso usati come agenti riducenti nelle reazioni organiche e organometalliche.
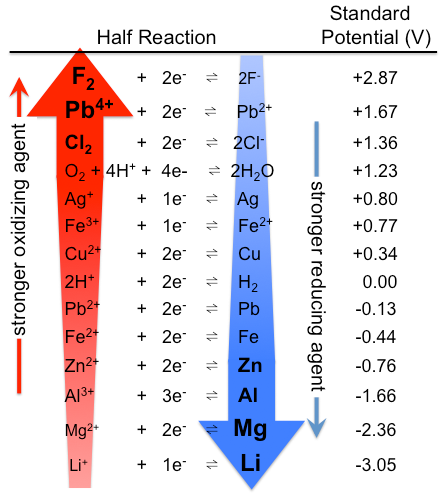
Figura \(\PageIndex{1}\): Tabella dei potenziali elettrodi standard. Si noti che la classifica è l’opposto qui, con forti agenti ossidanti in alto e forti agenti riducenti in basso, rispetto alla Tabella \ (\PageIndex{1}\). I potenziali effettivamente standard sono gli stessi, naturalmente. (CC BY-SA 3.0; Tem5psu).
Allo stesso modo, tutte le specie nella Tabella \(\PageIndex{1}\) che si trovano sopra H2 sono riduttanti più forti di H2 e quelle che si trovano sotto H2 sono più deboli. Il più forte riducente nella tabella è quindi il litio metallico, con un potenziale di elettrodo standard di -3,04 V. Questo fatto potrebbe essere sorprendente perché il cesio, non il litio, è l’elemento meno elettronegativo. L’anomalia apparente può essere spiegata dal fatto che i potenziali dell’elettrodo sono misurati in soluzione acquosa, dove le interazioni intermolecolari sono importanti, mentre i potenziali di ionizzazione e le affinità degli elettroni sono misurati nella fase gassosa. A causa delle sue piccole dimensioni, lo ion Li+ è stabilizzato in soluzione acquosa da forti interazioni elettrostatiche con l’estremità a dipolo negativo delle molecole d’acqua. Queste interazioni si traducono in una ΔHhydration significativamente maggiore per Li + rispetto a Cs+. Il metallo di litio è quindi il più forte riducente (più facilmente ossidato) dei metalli alcalini in soluzione acquosa.
I potenziali di riduzione standard possono essere interpretati come una classificazione delle sostanze in base al loro potere ossidante e riducente. Le specie nella Tabella \(\PageIndex{1}\) che si trovano sopra H2 sono agenti riducenti più forti (più facilmente ossidati) di H2. Le specie che si trovano al di sotto di H2 sono agenti ossidanti più forti.
Poiché le semireazioni mostrate nella Tabella \(\PageIndex{1}\) sono disposte in ordine di valori E°, possiamo utilizzare la tabella per prevedere rapidamente i punti di forza relativi di vari ossidanti e riduttanti. Qualsiasi specie sul lato sinistro di una mezza reazione ossiderà spontaneamente qualsiasi specie sul lato destro di un’altra mezza reazione che si trova sotto di essa nella tabella. Al contrario, qualsiasi specie sul lato destro di una mezza reazione ridurrà spontaneamente qualsiasi specie sul lato sinistro di un’altra mezza reazione che si trova sopra di essa nella tabella. Possiamo usare queste generalizzazioni per prevedere la spontaneità di un’ampia varietà di reazioni redox (E°cell > 0), come illustrato nell’esempio \(\PageIndex{1}\).
Esempio \(\PageIndex{1}\): Solfuro d’argento
L’appannamento nero che si forma sugli oggetti d’argento è principalmente Ag2S. La semireazione per invertire il processo di appannamento è la seguente:
- Facendo riferimento alla Tabella \(\PageIndex{1}\), prevedere quali specie—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—possono ridurre Ag2S ad Ag in condizioni standard.
- Di queste specie—H2O2(aq), Zn(s), I−(aq), Sn2+(aq), identificare quale è il più forte agente riducente in soluzione acquosa e quindi il miglior candidato per un prodotto commerciale.
- Dai dati nella Tabella \(\PageIndex{1}\), suggerisci un agente riducente alternativo prontamente disponibile, economico e possibilmente più efficace nel rimuovere l’appannamento.

Data: riduzione mezza reazione di elettrodo standard potenziale, e la lista dei possibili componenti
Chiesto: componenti per Ag2S, più forte riducente e potenziale agente riducente per la rimozione di offuscare
Strategia:
Dalle loro posizioni nella Tabella \(\PageIndex{1}\), decidere quali specie possono ridurre Ag2S. Determinare quale è la specie più forte riducente.
B Utilizzare Table \(\PageIndex{1}\) per identificare un riducente per Ag2S che è un prodotto domestico comune.
Soluzione
Possiamo risolvere il problema in due modi: (1) confrontare le posizioni relative dei quattro possibili riduttanti con quella della coppia Ag2S/Ag nella Tabella \(\PageIndex{1}\) o (2) confrontare E° per ogni specie con E° per la coppia Ag2S/Ag (-0.69 V).
- A Le specie nella Tabella \(\PageIndex{1}\) sono disposte dall’alto verso il basso in ordine crescente di forza riducente. Delle quattro specie indicate nel problema, I−(aq), Sn2+(aq) e H2O2(aq) si trovano sopra Ag2S e una si trova sotto di esso. Possiamo quindi concludere che Zn (s) può ridurre Ag2S(s) in condizioni standard, mentre I−(aq), Sn2+(aq), e H2O2(aq) non può. Sn2+(aq) e H2O2(aq) appaiono due volte nella tabella: sul lato sinistro (ossidante) in una mezza reazione e sul lato destro (riducente) in un altro.
- Il riducente più forte è Zn(s), la specie sul lato destro della semireazione che si trova più vicino al fondo della Tabella \(\PageIndex{1}\) rispetto alle semireazioni che coinvolgono I-(aq), Sn2+(aq) e H2O2(aq). (I prodotti commerciali che utilizzano un pezzo di zinco sono spesso commercializzati come” prodotto miracoloso ” per rimuovere l’appannamento dall’argento. Tutto ciò che serve è aggiungere acqua calda e sale per la conduttività elettrica.)
- B Dei riduttanti che si trovano sotto Zn (s) nella Tabella \(\PageIndex{1}\), e quindi sono riduttanti più forti, solo uno è comunemente disponibile nei prodotti per la casa: Al(s), che viene venduto come foglio di alluminio per avvolgere gli alimenti.
Esempio \(\PageIndex{2}\):
Usa i dati in Tabella \(\PageIndex{1}\) per determinare se la reazione è probabile che si verificano spontaneamente in condizioni standard:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Be(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Data: reazione redox e la lista dei potenziali di elettrodo standard (Tabella P2 )
Chiesto: reazione spontaneità
Strategia:
- Identificare il mezzo di reazioni in ogni equazione. Utilizzando la Tabella \ (\PageIndex{1}\), determinare i potenziali standard per le semireazioni nella direzione appropriata.
- Utilizzare l’equazione \(E_{cell}=E^o_{srp}(catodo) – E^o_{srp}(anodo)\) per calcolare il potenziale di cella standard per la reazione complessiva. Da questo valore, determinare se la reazione generale è spontanea.
Soluzione
- Uno stagno metallico viene ossidato a Sn2+(aq) e Be2+(aq) viene ridotto a berillio elementare. Possiamo trovare i potenziali elettrodi standard per quest’ultima (riduzione) semireazione (-1.85 V) e per la prima semireazione (ossidazione) (-0,14 V) direttamente dalla Tabella \(\PageIndex{1}\).
B Aggiunta di due semi-reazioni dà la reazione complessiva:
|
\(\textrm{catodo:} \; \mathrm{Essere^{2+}(aq)} +\mathrm{2e^-} \rightarrow \mathrm{Essere(s)}\) \(\textrm{anodo:} \; \mathrm{Sn(s) \rightarrow \mathrm{Sn^{2+}}(s)} +\mathrm{2e^-} \) \(\textrm{totale} \; \mathrm{Sn(s)+ \mathrm{Essere^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm{Essere(s)}\) |
\(E^\circ_{\textrm{catodo}}=\textrm{-1.99 V} \\ E^\circ_{\textrm{anodo}}=\textrm{-0.14 V} \\ E^\circ_{\textrm{cell}}=E^\circ_{\textrm{catodo}}-E^\circ_{\textrm{anodo}} \\ \hspace{5mm} =-\textrm{1.85 V}\) |
standard potenziale di cella è abbastanza negativo, quindi la reazione non si verifica spontaneamente come è scritto. Cioè, lo stagno metallico non può ridurre Be2+ al metallo di berillio in condizioni standard. Invece, il processo inverso, la riduzione degli ioni stannosi (Sn2+) da parte del berillio metallico, che ha un valore positivo di E°cell, avverrà spontaneamente.
- Un MnO2 è l’ossidante (Mn4+ è ridotto a Mn2+), mentre H2O2 è il riducente (O2− è ossidato a O2). Possiamo ottenere i potenziali elettrodi standard per le semireazioni di riduzione e ossidazione direttamente dalla Tabella \(\PageIndex{1}\).
B Le due semireazioni e i loro potenziali corrispondenti sono i seguenti:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ E^\circ_{\textrm{anodo}}=\textrm{0.70 V} \\ E^\circ_{\textrm{cell}}=E^\circ_{\textrm{catodo}}-E^\circ_{\textrm{anodo}} \\ \hspace{5mm} =-\textrm{0.53 V}\) |
standard potenziale per la reazione è positiva, indicando che, in condizioni normali, si verifica spontaneamente come è scritto. Il perossido di idrogeno ridurrà MnO2 e il gas di ossigeno si evolverà dalla soluzione.
Esercizio di \(\PageIndex{2}\)
Usa i dati in Tabella \(\PageIndex{1}\) per determinare se la reazione è probabile che si verificano spontaneamente in condizioni standard:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4OH−(aq) → 4MnO4−(aq) + 2H2O
Risposta
- spontanea (E°cella = 0.36 V)
- nonspontaneous (E°cella = -0.20 V)
Sebbene il segno di E°cell ci dica se una particolare reazione redox si verificherà spontaneamente in condizioni standard, non ci dice fino a che punto procede la reazione e non ci dice cosa accadrà in condizioni non standard. Per rispondere a queste domande è necessaria una comprensione più quantitativa della relazione tra potenziale cellulare elettrochimico e termodinamica chimica.
Sommario
Le forze relative di vari ossidanti e riduttanti possono essere previste utilizzando i valori E°. Le forze ossidative e riduttive di una varietà di sostanze possono essere confrontate utilizzando potenziali elettrodi standard. Le anomalie apparenti possono essere spiegate dal fatto che i potenziali dell’elettrodo sono misurati in soluzione acquosa, il che consente forti interazioni elettrostatiche intermolecolari e non nella fase gassosa.
Problemi concettuali
- L’ordine dei potenziali degli elettrodi non può sempre essere previsto dai potenziali di ionizzazione e dalle affinità degli elettroni. Perché? Ti aspetti che il metallo di sodio abbia un potenziale di elettrodo superiore o inferiore a quello previsto dal suo potenziale di ionizzazione? Qual è il suo potenziale di elettrodo approssimativo?
- Senza fare riferimento ai dati tabulati, di Br2 / Br -, Ca2 + / Ca, O2/OH− e Al3+/Al, quale ti aspetteresti di avere il potenziale di elettrodo meno negativo e quale il più negativo? Perché?
- A causa degli amminoacidi contenenti zolfo presenti negli albumi, mangiare uova con una forchetta d’argento appanna la forchetta. Come chimico, avete tutti i tipi di prodotti per la pulizia interessanti nel vostro armadio, tra cui una soluzione di 1 M di acido ossalico (H2C2O4). Sceglieresti questa soluzione per pulire la forchetta che hai appannato dal mangiare uova strapazzate?
- Il potenziale dell’elettrodo per la reazione Cu2+(aq) + 2e− → Cu(s) è 0,34 V in condizioni standard. Il potenziale di ossidazione di 0,5 mol di Cu è pari a -0,34 / 2 V? Spiega la tua risposta.
- Fare riferimento alla Tabella \(\PageIndex{1}\) per prevedere
- Quali specie—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) e / o H2O2(aq)—possono ossidare MnO2(s) a MNO4− in condizioni standard.
- Quale specie—Sn4+(aq), Cl−(aq), Ag+(aq), Cr3+(aq) e/o H2O2(aq)—è il più forte agente ossidante in soluzione acquosa.
Risposta concettuale
- No; E° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply