Vogt-Koyanagi-Harada (VKH) Betegség
Szerzők: Anthony P. Mai, B; Charlene Tran, B; Caroline W. Wilson, MD; Austin R. Róka, MD; H. Culver Boldt, MD
április 1, 2019
a KEZDETI BEMUTATÓ
Főnök Panasz
Homályos látás, fejfájás
a Történelem a Jelen Betegség
A 44 éves Vietnámi nő bemutatta, hogy a sürgősségi osztály 10-nap története progresszív homályos látás mindkét szemmel, majd három nap története súlyos fejfájás. Központi látáskárosodása nem javult az optometrista refrakciójával. Súlyos nyakszirti fejfájása mozgással súlyosbodott, és általános rossz közérzethez, extrém fáradtsághoz, enyhe fényérzékenységhez és szakadáshoz társult. Az acetaminofen részben enyhítette a fájdalmat.
nemrég Vietnamba utazott, de tagadta, hogy ott találkozott volna beteg kapcsolatokkal. Tagadta az állkapocs-sántítást, lázadást vagy súlyváltozást. Tagadta a bőrkiütéseket, a hallásváltozásokat, a fülzúgást, a szédülést, a zsibbadást vagy a bizsergést. Tagadta, hogy valaha tuberkulózisa volt. Nem volt kórtörténetében korábbi látási problémák, autoimmun állapotok, vagy a rák.
Elmúlt Szemészeti Történelem
- a Történelem, a kozmetikai szemhéj műtét (kétoldalú szemhéjplasztika) három évvel azelőtt,
- Nincs történelem, szemészeti trauma vagy betegség
anamnézisében
Nincs
Gyógyszerek
a Paracetamol szükség
Allergia
Nem ismert gyógyszer allergia
Családban
Nem a történelem, a betegséget, vagy autoimmun betegség,
Szociális Történelem
Ő vándorolt ki a Vietnam-több éve előtt bemutatása. Nős, három gyermeke van. Egy körömszalonban dolgozik. Nem fogyaszt dohánytermékeket, alkoholt vagy tiltott anyagokat. Hat-tizenkét havonta utazik Vietnamba.
Felülvizsgálata Rendszerek
Negatív, kivéve a részletes, a történelem, a jelen betegség
SZEMÉSZETI VIZSGÁLAT
Látásélesség a/korrekció nélkül (Snellen)
- a Jobb szem (OD): 20/300 (nincs javulás a lyukra)
- a Bal szem (OS): 20/60-2+2 (nincs javulás a lyukra)
Szemészeti Motilitás/Igazítás
a Teljes extraokuláris mozgások mindkét szeme (OU)
szemnyomás (IOP): (Tonopen)
- OD: 12 hgmm
- OPERÁCIÓS rendszer: 14 hgmm
a Tanulók
- OD: 4 mm vastag, sötét, 3 mm, fény, nem relatív afferent pupilla hiba (RAPD)
- OPERÁCIÓS rendszer: 4 mm vastag, sötét, 3 mm-es, a fény, nem RAPD
Konfrontáció vizuális mező: (Gróf ujjak)
- OD: Centrális scotoma
- OPERÁCIÓS rendszer: Teljes inferotemporal hiba
Külső
Normál mindkét oldalon
réslámpa vizsga
- a Fedeleket/szempillák: Normál OU
- Kötőhártya/sclera: Tiszta, csendes OU
- Szaruhártya: 1+ punctata epithelialis erózió, nem keratic kicsapódik OU
- Elülső kamra: Trace cellára, majd fáklyát, mély OU
- Iris: Normál építészet OU
- Lencse: Tiszta OU
Kitágult fundus vizsgálata (a dfe)
- Üveges: Trace elülső üveges sejtek OU
- Lemez:
- OD: 3-as Fokozatú lemez ödéma, hyperemic
- OPERÁCIÓS rendszer: Grade 2-3 lemez ödéma, hyperemic
- – Kupa-to-disc arány: 0.0 OU
- Macula:
- OD: 3+ cystoid macula ödéma (CME), valamint subretinal folyadék (SRF) kiterjesztése a lemezről, hogy a temporális macula. Nincs lipid vagy váladék. Boggy-megjelenő choroid.
- OS: 2 + CME és SRF. 1-2 + lineáris lipid, amely a lemezről a fovea felé terjed. Boggy-megjelenő choroid.
- Hajók:
- OD: Shathing temporally
- OS: Normal
- periféria:
- OD: cisztás retina tuft elülső az Egyenlítő 10:30
- OS: sekély SRF elülső az Egyenlítő 4:00
 |
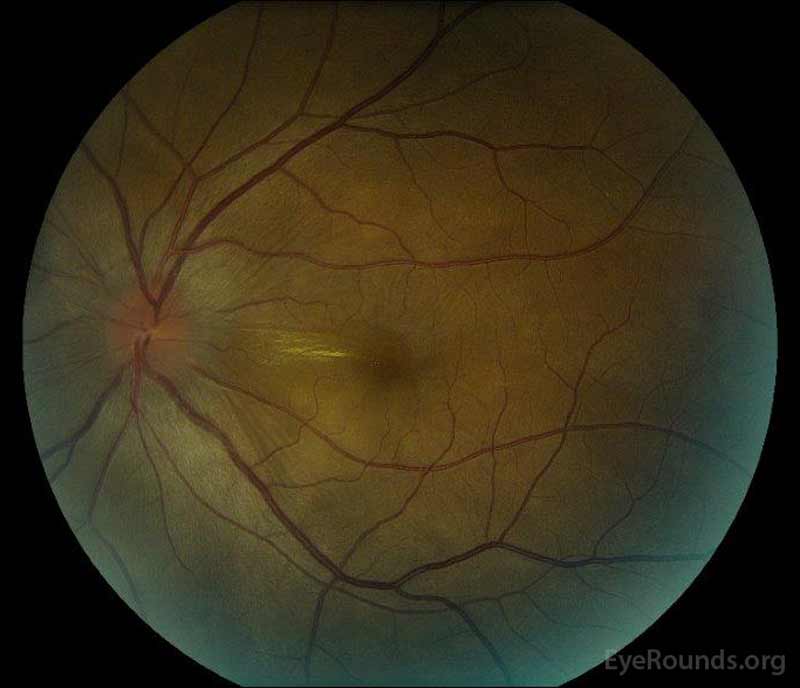 |
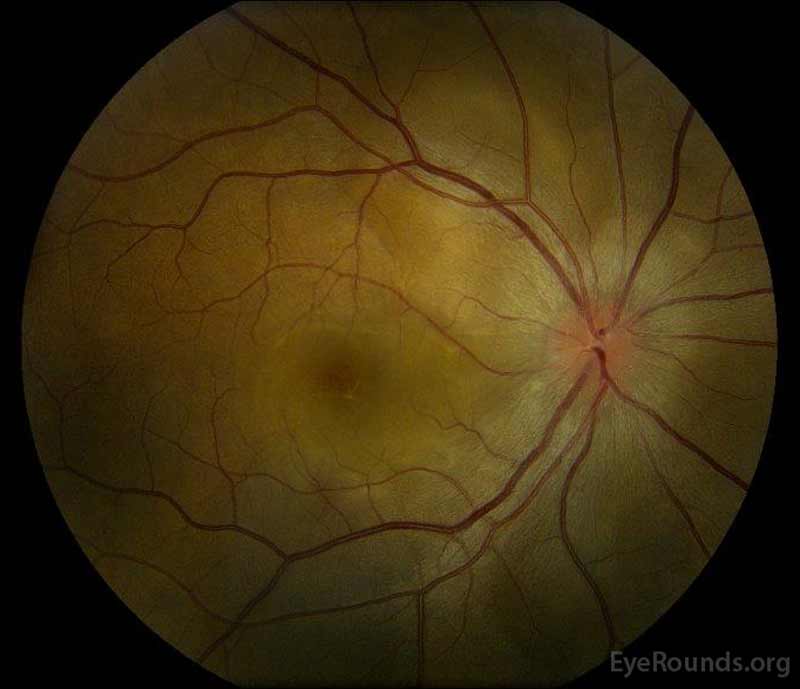
1. Ábra: Színes fundus fényképek a bemutatót: (Bal kép), A jobb szem lemez ödéma, enyhe vérbőséget, valamint subretinal folyadék kiterjesztve a lemez időben, keresztül a macula. Van is egy fokális savós retina leválás superotemporális a lemez mentén superior arcade. (Right image) The left eye has disc edema and mild hyperemia, along with subretinal fluid extending from the disc to the macula and linear lipid deposits in the nasal macula.
 |
 |
 |
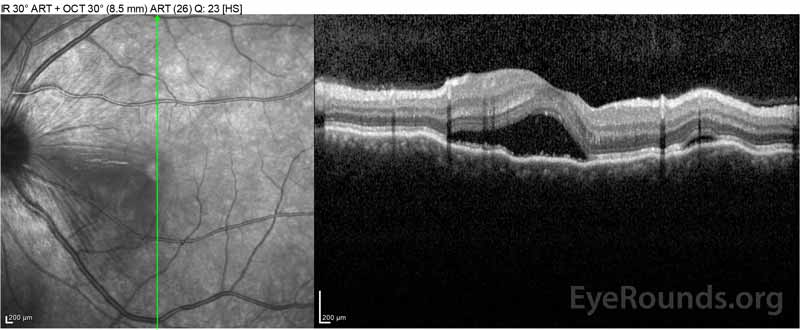 |
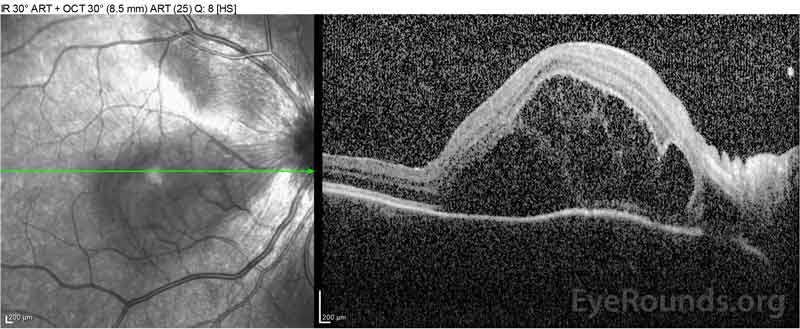
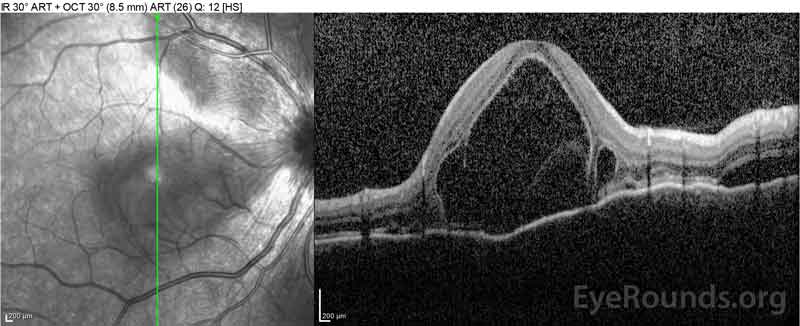
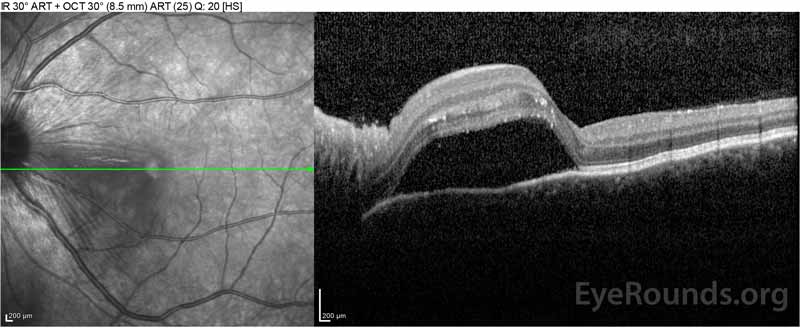
Figure 2: Optikai koherencia tomográfia (OCT), a jobb szem (felső panel) azt mutatja, savós retinaleválás bevonásával a fovea kiterjedt fedő intraretinal folyadék, zavar a külső retinális rétegek, valamint a hullámok a megvastagodott choroid. Okt a bal szem (alsó panelek) azt mutatja, egy savós retinaleválás az orr makula kiterjesztve a fovea.
 |
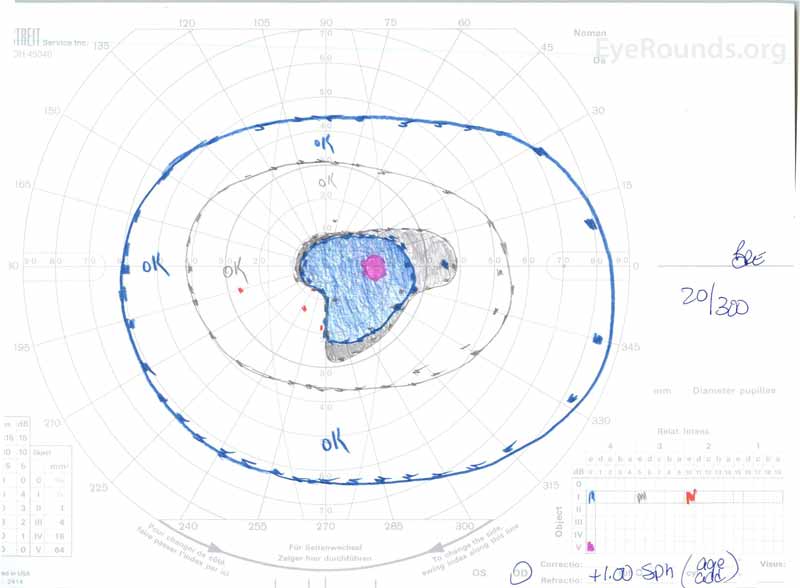 |
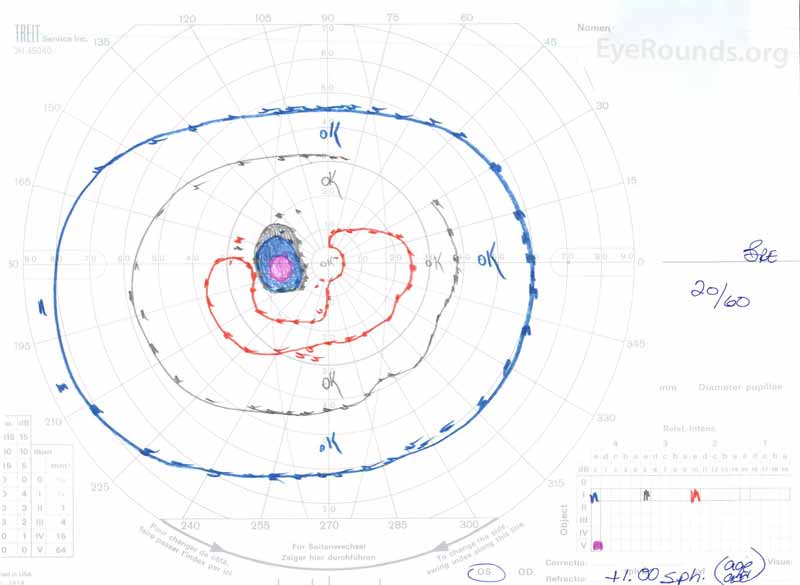
3. ábra: Goldman vizuális mezők( GVF), OU. (Bal oldali kép) az OS megnagyobbodott fiziológiás vakfoltot és enyhe központi scotomát mutat. (Jobb oldali kép) az OD egy közepesen sűrű központi scotomát mutat, amely magában foglalja a fiziológiás vakfoltot és kiterjeszti az inferotemporálisan.
B-scan: Nincs jele scleritis, enyhe vitreal homályok/sejtek inferiorly
Differenciál Diagnózis
- Akut hátsó multifokális pikkelyek pigment epitheliopathy (APMPPE)
- Közép-savós chorioretinopathy
- Optikai szemideg
- Panuveitis
- Autoimmun betegség (pl., SLE, sarcoidosis)
- – Fertőzés (e.g., a szifilisz, a tbc, a Bartonella henselae)
- Rosszindulatú daganat (pl. szemészeti lymphoma)
- Hátsó scleritis
- Szimpatikus ophthalmia
- Uveal folyadékgyülem szindróma
- Vogt-Koyanagi-Harada Szindróma
MUNKA-UP
a Teljes vérkép,
fehérvérsejt száma: 4.9 K/mm3 (Ref: 3.7-10.5)
vörösvértestszám 3.99 M/mm3 (Ref: 4.0-5.2)
Hemoglobin 11.6 g/dL (Ref: 11.9-15.5)
Hematokrit 35 % (Ref: 35-47)
Basic metabolic panel
Sodium 138 mEq/L (Ref: 135-145)
Potassium 4.3 mEq/L (Ref: 3.5-5.0)
Chloride 107 mEq/L (Ref: 95-107)
CO2 20 mEq/L (Ref: 22-29)
Blood urea nitrogen 16 mEq/dL (Ref: 10-20)
Creatinine 0.7 mg/dL (Ref: 0.5-1.0)
C-reactive Protein (CRP): <0.5 mg/dL (Ref: <=0.5)
Erythrocyte sedimentation rate (ESR): 12 mm/Hr (Ref: 0-20)
Angiotensin–converting enzyme (ACE): 13 U/L (Ref: 8-52)
QuantiFERON-TB Gold: negatív
Vas, vér 54 mikrogramm/dL (Ref: 37-145)
Teljes vas kötelező kapacitás 379 mikrogramm/dL (Ref: 250-425)
KLINIKAI TANFOLYAM
A beteg kezdetben értékelte a sürgősségi osztály adott neki panaszok újonnan kialakuló, súlyos fejfájás, látászavar. Az agyi komputertomográfia (CT) és a mágneses rezonancia képalkotás (MRI) vizsgálata nem volt figyelemre méltó. Az ESR és a CRP normál szinten voltak. A szemészeti klinika másnap megvizsgálta, és kétoldali savós retinaleválasztást és panuveitist talált. Az ACE és a QuantiFERON-TB Aranylaborok egyaránt negatívak voltak. Klinikai előadása és ázsiai származása alapján Vogt-Koyanagi-Harada-kórt diagnosztizáltak nála. Naponta 80 mg prednizonnal, fejfájás esetén acetaminofennel, D-vitaminnal és kalciumpótlással kezelték. A fejfájása gyorsan enyhült, és a látásélessége a következő két hétben folyamatosan javult. A prednizon adagját ezután három hét alatt 40 mg-ra csökkentették a tünetek folyamatos megszűnésével és a látásélesség javulásával. A prednizon taper alatt nem volt fejfájás vagy látásromlás. Legutóbbi találkozóján minden második napon 5 mg-ra csökkent, a tünetek visszatérése nélkül. A látásélessége a nyomon követés során 20/15-2 OD és 20/20+2 OS volt, a macularis OCT pedig a korongödéma és a savós retinális leválások teljes felbontását mutatta mindkét szemben (4.ábra).
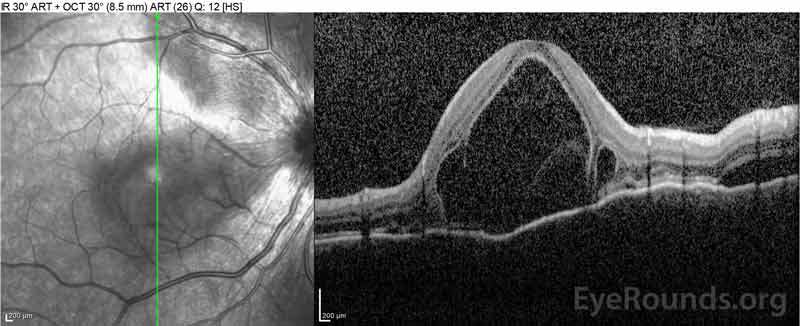
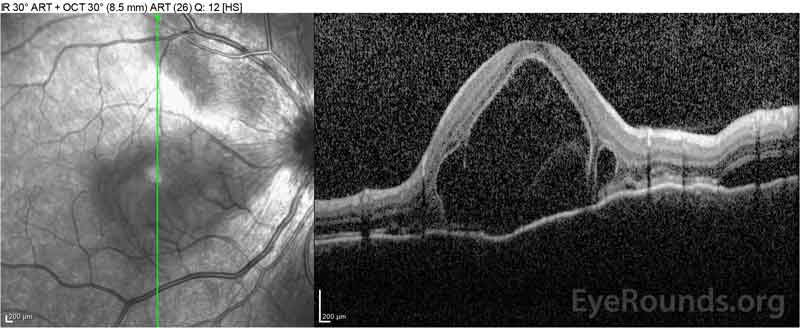
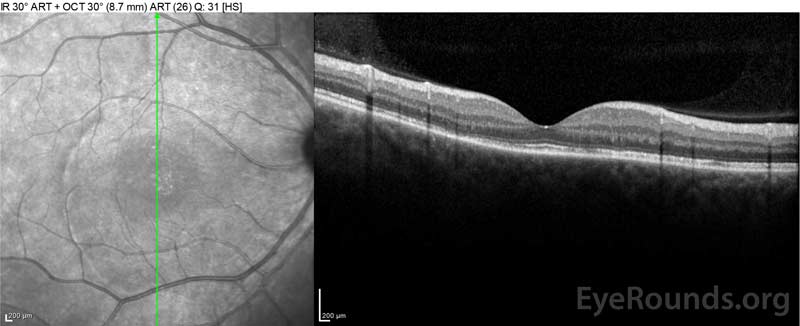
4. ábra: Optikai koherencia tomográfia, amely a szubretinális folyadékot mutatja a kiindulási (felső) és a felbontási folyamatot egy héten (középső) és öt héten (alsó), miközben nagy dózisú orális prednizon kúpos. Vegye figyelembe a koroid hullámzások simítását a kezeléssel.
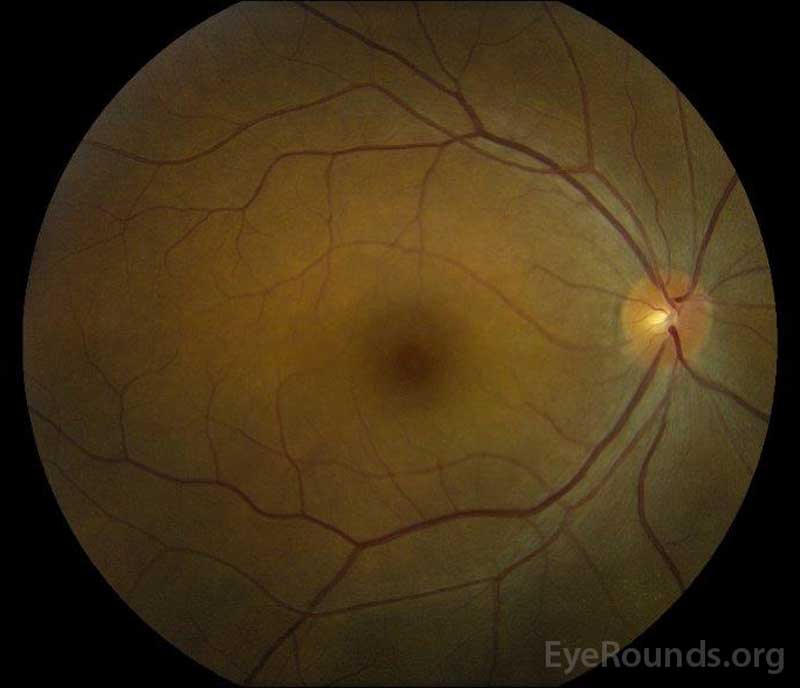 |
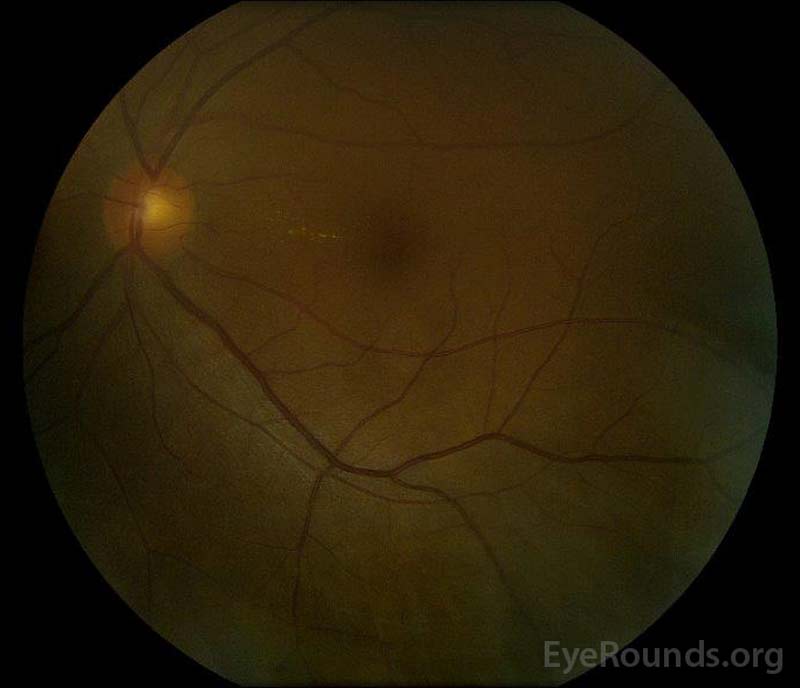 |
5. ábra: Színes fundus fényképezés a jobb (A) és a bal (B) szem alatt lábadozás fázis javulást mutat a subretinalis folyadék és a lemez ödéma.
DIAGNÓZIS
Hiányos, Vogt-Koyanagi-Harada Betegség
a VITA
Vogt-Koyanagi-Harada (VKH) Betegség szisztémás autoimmun betegség jellemzi kétoldalú nem nekrotizáló granulomatosus panuveitis kapcsolódó extraokuláris integumentary változások, mint például a paralízis, valamint vitiligo, valamint gyulladás érinti az uvea, belső fül, haj, agyhártya. A Harada-betegség az izolált uveitis, a VKH szisztémás jelei vagy tünetei nélkül.
etiológia
a VKH-betegség etiológiája a jelenlegi kutatási erőfeszítések ellenére még mindig nagyrészt ismeretlen. Azt hittem, hogy egy szerzett autoimmun betegség járó T-sejt-mediált túlérzékenység melanocytic self-antigének, a mögöttes genetikai hajlam, illetve esetleges mikrobiális ravaszt . A tirozináz és a tirozinázhoz kapcsolódó peptidek melanocita antigének, amelyeket a VKH autoimmun folyamatainak célpontjaként javasoltak . Egy tanulmány szerint azonban a VKH-betegség fokozott kockázata nem társult a tirozináz géncsaláddal .
az egyes etnikai és nemi csoportok körében megnövekedett prevalencia miatt úgy gondolják, hogy genetikai hajlam van a VKH patogenezisében. Különböző etnikai populációkban több gén, köztük a humán leukocita antigén (HLA) és az interleukin (IL) gének kapcsolódtak a VKH-hoz . A HLA receptorok fő hisztokompatibilitási komplexek olyan emberekben, amelyek peptideket mutatnak az immunrendszernek. A HLA-DR1, a HLA-DR4, a HLA-DRB1*0405 és a HLA-DRw53 számos haplotípus, amelyet VKH-betegségben szenvedő betegeknél találtak . A HLA-DR4 gyakoribb Japán és spanyol embereknél, míg a HLA-DRB1*0405 gyakoribb a koreai és közel-keleti betegeknél . Mind a HLA-DR4, mind a HLA-DRB1*0405 allélok vietnami betegekben találhatók . A HLA-DRB1 receptor különböző kapacitással kötődik a melanocita antigénekhez. Ezen társulások ellenére a genetikai tesztelés jelenleg nem ajánlott.
tekintettel a VKH-t kísérő szokásos prodromális tünetekre, beleértve a lázat, a fejfájást, a meningismust és a fülzúgást, a VKH kialakulását kiváltó vírus etiológiát javasoltak molekuláris mimikri mechanizmusokon keresztül genetikailag hajlamos betegeknél. A cytomegalovírus boríték glikoprotein h jelentős aminosav homológiával rendelkezik a tirozináz peptiddel szemben, és a CMV-fertőzés VKH-t válthat ki molekuláris mimikrián keresztül (azaz a HLA-osztály II receptorok általi felismerés) . Az Ebstein-bar vírus (EBV) szintén érintett. A VKH vírus etiológiájára vonatkozóan azonban nem volt végleges bizonyíték, és továbbra sem világos, hogy mi váltja ki a VKH autoimmun választ .
patofiziológia
a VKH négy klasszikus fázisa van, amelyek változó prezentációkkal rendelkezhetnek: prodromális, akut uveitikus, lábadozó és krónikus-visszatérő. A kórszövettani változások általában az akut fázisban kezdődnek .
az akut uveitikus fázist a granulomatózus gyulladás másodlagos uveális megvastagodása jellemzi. A granulomák limfocitákból, makrofágokból, granulátummal töltött epithelioidokból és óriássejtekből állnak . Bár az epithelioid sejteket korábban úgy vélték, hogy megváltoztatják a melanocitákat, egy követő immunhisztokémiai vizsgálat inkább a szöveti makrofágok eredetét javasolta . Az epithelioid histiocitákkal, Dalen-Fuchs csomóknak nevezett granulomák gyakran láthatók a retinális pigment epithelium (rpe) és a Bruch membránja között. Az uveális granulomatózus gyulladás koroid megvastagodáshoz és protein-folyadékkal töltött exudatív retina leváláshoz vezet. Ezen kívül pleocytosis (i.e. megnövekedett sejtszám) jelen lehet az elülső kamrában és üveges .
a lábadozó fázist a koroid és az extraokuláris területek depigmentációja határozza meg, beleértve a szem körüli bőrt és a hajat is. A sápadt látóideg elleni depigmentált koroid egy “sunset-glow” fundus benyomását kelti, amely a VKH ezen fázisának klasszikus jellemzője . Ezenkívül a Dalen-Fuchs csomók az RPE alatt kiemelkedőbbé válnak a lábadozó fázisban .
a krónikus-visszatérő fázist a csökkent kororoid vastagság, a savós retinális leválások felbontása, a krónikus enyhe vitritisz, valamint a visszatérő granulomatózus elülső szegmens gyulladása jellemzi. Ebben a fázisban koroid neovaszkularizáció (CNV) és szubretinális fibrózis alakulhat ki, amelyek a betegség súlyos progressziójának mutatói . A szürkehályog és a másodlagos glaukóma a régóta fennálló vagy visszatérő gyulladás egyéb szövődményei ebben a fázisban .
a VKH a sötétebb bőrszínű pigmentekkel rendelkező fajokban fordul elő, különösen az ázsiaiak, a dél-amerikaiak, a Közép-keletiek és az őslakosok körében. A VKH-betegség az uveitis >10% – át teszi ki ezekben a populációkban . Az uveitis eseteinek csak 1-4% – át gondolják másodlagosnak a VKH-betegséghez az Egyesült Államokban (7). Az Egyesült Államokban a VKH legtöbb esetét ázsiai, spanyol és/vagy őslakos amerikai állampolgárokra találták ki . Érdekes, hogy a VKH-betegség sötét pigmentációjuk ellenére ritkán érinti az afrikaiakat . A VKH-betegség előfordulási gyakorisága nagymértékben változik a szomszédos országok faji alcsoportjai között . Például Korea VKH előfordulása csak 2%, sokkal alacsonyabb, mint Japánban és Kínában .
A VKH tipikus előfordulása 20-50 éves; a vizsgálatok azonban arra utalnak, hogy a VKH esetek 3, 1-13, 4%-a gyermekkorú, az esetek 10%-a ≥65 éves . Klasszikusan úgy gondolják, hogy a VKH hajlamos a női nemre, és bár a legtöbb tanulmány azt mutatja, hogy a VKH aránytalanul érinti a nőket, néhány tanulmány kimutatta a férfiak hajlamát, vagy nincs nemi hajlam .
jelek/tünetek
mint már említettük, a VKH-betegség négy szakasza prodromális, uveitikus, lábadozó és krónikus visszatérő. Minden szakasz különálló klinikai jellemzőket mutat.
- Prodromal: ez a kezdeti szakasz influenzaszerű betegségként jelentkezhet, amelynek túlnyomórészt alkotmányos tünetei vannak, mint például fejfájás, szédülés, láz, fáradtság és/vagy hányinger. Beszámoltak agyhártyagyulladás, agyideg-bénulás és látóideg-gyulladás neurológiai tüneteiről, valamint fülzúgás, dysacusis és vertigo hallási tüneteiről . A fotofóbia, homályos látás, úszók és/vagy szemfájdalom általában a prodromális tüneteket követő 48 órán belül kezdődik . A prodromális fázis általában néhány naptól hetekig tart.
- akut Uveitic: ez a szakasz magában foglalja a homályos látás, fényérzékenység, kötőhártya injekció, szemfájdalom. Enyhe elülső uveitis lehet, amely először nem granulomatosnak tűnik. Az egyoldalú megjelenés általában 1-2 héten belül átáll a kétoldalú bevonásra. Granulomatózus elülső uveitis alakulhat ki birka-zsír keratikus csapadékkal. Posterior vizsga megállapítások lehetnek látóideg ödéma és hyperemia, multifokális területek choroiditis, több területen savós retinaleválás lokalizált a posterior fundus, choroidal megvastagodása, sugárzó chorioretinalis redők, vitritis . A savós retinális leválások a hátsó fundusban kloverleaf mintát képezhetnek, súlyos esetekben pedig kiterjedt bullous leválasztásokhoz vezethetnek . Akut gyulladásos glaukóma összefüggésbe hozható ez a fázis a betegség lehet jelen egy sekély elülső kamra másodlagos sugártest ödéma, utánozva akut-szög bezárása . Az akut uveitikus fázis időtartama a gyors diagnózistól és kezeléstől függ.
- krónikus Uveitic vagy lábadozó: ez a szakasz általában az akut fázis után néhány héttel alakul ki, és vitiligo (pl. arc, kéz, váll vagy hát), poliosis és alopecia jellemzi . A szaruhártya limbus közelében lévő depigmentáció, amelyet Sugiura jelének neveznek, egy hónappal a betegség kezdete után látható ; ezt a jelet azonban ritkán látják a japán lakosságon kívül . A koroid depigmentáció általában néhány hónap alatt következik be, ami a koroid élénk narancssárga-vörös színét, valamint a klasszikus “sunset glow fundus” – ot eredményezi.”A Sunset glow fundus a krónikus VKH diagnózisában a legfontosabb és prediktív . Jól definiált, kerek, nummuláris chorioretinális hegek alakulhatnak ki a periféria közepén. A krónikus uveitikus fázis általában több hónapig tart.
- krónikus-visszatérő: Ebben a szakaszban jellemzi visszatérő epizódok granulomatosus anterior uveitis a birka kövér keratic kicsapódik, iris csomók, szivárványhártya színét, hátsó synechiae, hátsó szürkehályog kialakulását, másodlagos glaukóma, choroidea neovaszkuláris membránok, s végső soron a subretinal fibrózis, valamint nummular chorioretinal sorvadás . A krónikus fázis általában a kezdeti megjelenítés után legalább hat hónappal alakul ki. Az akut és lábadozó fázisokban jelen lévő savós retina leválások általában nem ismétlődnek meg agresszív kortikoszteroid kezeléssel .
diagnosztikai kritériumok
a legutóbbi diagnosztikai kritériumokat, amelyeket a Vkh felülvizsgált diagnosztikai kritériumainak (RDC) neveztek el, 1999-ben határozták meg a VKH első nemzetközi műhelyében . Ezeket az 1. táblázat tartalmazza. Az RDC akkor hasznos, ha a VKH-t három különböző diagnosztikai kategóriára osztják a betegség fázisa alapján, amely alatt a beteg bemutatja: teljes, hiányos és valószínű. Ez a kategorizálás a betegség lehetővé teszi a megfelelő és korai kezelése” valószínű “betegség, amely segíthet megelőzni a progresszió “teljes” betegség.
a szemgyulladás egyéb okainak, mind a fertőző, mind az auto-gyulladásos problémáknak a kidolgozása elengedhetetlen. Ezek közé tartoznak a vörösvérsejt-üledékképződés (ESR), a C-reaktív fehérje (CRP), a quantiferon-arany tuberkulózis vizsgálata, a szifilisz gyors plazma reagin (RPR), az angiotenzin-konvertáló enzim (ACE) és a mellkasi röntgen a szarkoidózisra, az antinukleáris antitest (ANA) és a p-/c-ANCA. Meg kell jegyezni továbbá a közelmúltban történt szemsérülést vagy intraokuláris műtétet, és valószínűleg szimpatikus szemészetet (tehát) javasol, mivel a valószínűbb diagnózis az SO és a VKH között megosztott nagyon hasonló prezentáció és patofiziológia miatt .
a VKH diagnózisának alátámasztására kétértelmű esetekben lumbális punkciót lehet végezni lymphocytás és monocita pleocytosis keresésére; ezt azonban ritkán alkalmazzák klinikailag. A betegek nyolcvan százaléka egy héten belül pleocitózissal rendelkezik a cerebrospinális folyadékban (CSF), 97% – uk pedig három héten belül pleocitózissal rendelkezik. Az immunsejtek megnövekedett szintje a betegség kialakulását követő nyolc hétig tarthat . A T-sejt felszíni markerprofiljai hasonlóak a CSF és a vizes humor között, de különböznek a vérétől. Ez arra utal, hogy a CSF képes pontosan tükrözni a VKH-betegség uveális gyulladását .
1. táblázat. Felülvizsgált diagnosztikai kritériumok Vogt-Koyanagi-Harada betegség
* a táblázat 1 in (15).
” teljes Vogt-Koyanagi-Harada betegség (az 1-5.kritériumnak jelen kell lennie)
- az uveitis kezdeti megjelenését megelőzően nem fordult elő Áthatoló szemsérülés vagy műtét.
- nincs olyan klinikai vagy laboratóriumi bizonyíték, amely más szemészeti betegségekre utalna.
- kétoldalú szemészeti beavatkozás (a vagy b-nek teljesülnie kell, a beteg vizsgálatakor a betegség stádiumától függően).
- a betegség korai megnyilvánulása.
- Ott kell, hogy legyen bizonyíték a diffúz choroiditis (vagy anélkül anterior uveitis, üveges gyulladásos reakció, vagy optikai lemez vérbőség), ami nyilvánvaló, mint az alábbi:
- a betegség korai megnyilvánulása.
- Súlyponti területek subretinal folyadék, vagy
- Bullosus savós retina különítmények.
- A kétes fundus megállapítások; mindketten a következő is jelen kell lennie:
- fókuszterület a késedelem a choroidea perfúziós, multifokális területeken pontosan szivárgás, nagy pikkelyek területeken hyperfluorescence, összevonása belül subretinal folyadék, valamint a látóideg festés (felsorolt sorrendben egymást követő megjelenés) által fluoreszcein angiográfia, illetve
- Diffúz choroidea megvastagodása, bizonyíték nélkül, a hátsó scleritis által ultrahang.
- a betegség késői megnyilvánulása.
- A történelem a 3a-ból származó eredmények előzetes jelenlétére utal, és vagy az alábbi (2) és (3), vagy a (3) több jele:
- szem depigmentáció (a következő megnyilvánulások egyike elegendő): a) Sunset glow fundus, vagy b) Sugiura jel.
- egyéb szemészeti tünetek:
- Nummular chorioretinal depigmented scars, or
- retina pigment epithelium clumping and / or migration, or
- visszatérő vagy krónikus anterior uveitis.
- neurológiai / hallási eredmények (a vizsgálat idejére rendeződhettek).
- Meningismus (rossz közérzet, láz, fejfájás, hányinger, hasi fájdalom, a nyak és a hát merevsége, vagy ezek kombinációja; a fejfájás önmagában nem elegendő a meningismus meghatározásának teljesítéséhez), vagy
- Tinnitus, vagy
- li > li > cerebrospinális folyadék pleocytosis.
- Integumentary finding (nem a központi idegrendszer vagy a szem betegség kialakulása előtt).
- Alopecia, vagy
- Poliosis, vagy
- Vitiligo.
Hiányos, Vogt-Koyanagi-Harada betegség (kritériumok 1 3 vagy 4 vagy 5 jelen kell lennie)
- Nincs történelem, átható szem trauma vagy műtét előző, az első fellépő uveitis, meg
- Nincs klinikai vagy laboratóriumi bizonyíték arra utaló más szemészeti betegség szervezetek, valamint
- Kétoldalú szemészeti bevonása.
- neurológiai / hallási eredmények; a fenti teljes Vogt-Koyanagi-Harada-betegség meghatározása szerint, vagy
- Integumentary eredmények; a fenti teljes Vogt-Koyanagi-Harada-betegség meghatározása szerint.
Valószínű, Vogt-Koyanagi-Harada betegség (elszigetelt szemészeti betegség; kritériumok 1 3 jelen kell lennie)
- Nincs történelem, átható szem trauma vagy műtét előző, az első fellépő uveitis.
- nincs olyan klinikai vagy laboratóriumi bizonyíték, amely más szemészeti betegségekre utalna.
- kétoldalú szemészeti beavatkozás a fenti teljes Vogt-Koyanagi-Harada betegség meghatározása szerint. “
tesztelés/laboratóriumi munka-up
a VKH kezdeti szakaszában fontolóra kell venni a következő vizsgálatok elvégzését:
- optikai koherencia tomográfia (OCT): Az akut uveitikus fázisban az OCT valószínűleg jelentős koroid megvastagodást és savós retinális elváltozásokat mutat. A szubretinális folyadékfelhalmozódásnak lehetnek fibrin membránjai és gyulladásos termékei, ami lobularis struktúrát hoz létre, amely a fluoreszcein angiográfián is látható. A lábadozó fázisban az OCT képes kimutatni a retina elvékonyodásának területeit a kortikoszteroid kezelés után megoldódott gyulladás után .
- B-scan ultrasonography: Az akut fázisban az ultrahangvizsgálat diffúz posterior choroidalis megvastagodást, posterior scleralis megvastagodást, retina leválasztást és üveges opacitást mutathat . Az ultrahang biomikroszkópiával ciliáris effúziók figyelhetők meg . Ez a teszt hasznos a hátsó scleritis kizárására is.
- fluoreszcein angiográfia (FA): klasszikusan az FA a korai fázisban multifokális kororoid hypofluoreszcens pontokat tár fel, amelyeket többszörös fókuszos hiperfluoreszcens területek követnek, diffúz szivárgással a késői fázisban . A festék az RPE-n keresztül szivárog, és a hiperfluoreszcens pontokat körülvevő szubretinális térben halmozódik fel. Az FA diagnosztikusan hasznos lehet, ha a VKH-betegség extraokuláris tünetek nélkül jelentkezik. Az atrófiás korioretinális hegek által okozott optikai lemez-hiperfluoreszcencia és ablakhibák a középső periférián láthatók . FA a krónikus-visszatérő szakaszában VKH betegség azt mutatja, nem specifikus ablak hibák miatt rpe károsodás, koroid neovaszkularizáció, szubretinális fibrózis .
- Indocianin zöld (ICG) angiográfia: A korai fázisú ICG olyan hiperfluoreszcens stromális ereket ábrázol, amelyek a koroid vasculopathiát és a hypofluoreszcens sötét pontokat jelzik, amelyek megfelelnek a granulomáknak és a koroid érrendszer késleltetett foltos kitöltésének . A késői fázis fuzzy stromális érrendszereket és diffúz koroid hiperfluoreszcenciát tár fel. A lemez hiperfluoreszcenciája súlyos betegségre utal. Az ICGA nagyon korai stádiumban vagy akár szisztémás terápia után is képes kimutatni a szubklinikai koroid gyulladást .
- lumbálpunkció: a Vkh betegek többségében Pleocytosis van a cerebrospinális folyadékban. Lumbálpunkció kell végezni a betegség korai szakaszában, persze, mivel pleocytosis megoldhatja
Kezelés/Menedzsment/Iránymutatás
Kezelési célok a VKH közé tartozik a korai diagnózis pedig elnyomása aktív gyulladás, valamint a megelőzés, a visszatérő gyulladás, látást veszélyeztető szövődmények, mint például a glaukóma, bullosus retinaleválás, valamint choroidea neovascularization.
a szisztémás kortikoszteroid kezelés a VKH-betegség előnyös terápiája, különösen az akut uveitikus szakaszban. Kimutatták, hogy a kortikoszteroidok beadásának módja (orális vagy intravénás) nem befolyásolja a látásélességet vagy a vizuálisan jelentős szövődmények előfordulását az akut VKH kezelésében . Súlyos betegség esetén a javasolt protokoll az intravénás metilprednizolon beadása három napig, majd az orális nagy dózisú prednizon kezelés. Enyhe-közepesen súlyos betegség esetén a nagy dózisú orális prednizon elegendő lehet 1-2mg/kg/nap adagban. A szteroid adagját lassan, körülbelül hat hónap alatt kell csökkenteni a megismétlődés megelőzése érdekében . Agresszív korai kezelés mellett soros FA vizsgálat eltűnését mutató festék szivárgás az RPE, segíthet megelőzni a további betegség progresszióját, kiújulás, és extraokuláris megnyilvánulásai . A lokális szteroidok és a cikloplegikumok csökkenthetik az elülső kamra és az üvegtest sejtjeit.
a triamcinolon intravitrealis és subtenon injekcióit az intraokuláris gyulladás rövid távú szabályozására alkalmazták az akut vagy visszatérő fázisokban; ezeket a helyi terápiákat figyelembe kell venni ellenszenves betegség esetén, valamint azoknál a betegeknél, akik rosszul tolerálják a szteroidok kedvezőtlen szisztémás mellékhatásait a kiterjesztett szteroid kúposság miatt. Az intravitrealis anti-VEGF injekciókat néha a koroid neovaszkularizáció szabályozására, valamint tartós foveális savós retinális leválások esetén alkalmazzák .
Szteroid-spóroló szerek, beleértve a antimetabolites, calcineurin gátlók, biológiai, TNF-alfa gátlók, vagy citotoxikus szerek lehet használni kezelésére VKH és gondosan monitorozni kell, gyakran együttműködve egy reumatológus szolgáltatás . A nem-szteroid immunszuppresszív szerek VKH-betegség első vonalbeli kezeléseként történő alkalmazásáról folyamatos vita folyt. Egy nemrégiben készült tanulmány azonban nem tárt fel különbséget az eredmények között a korai első vonalbeli immunmoduláló kezelés (IMT) és az önmagában alkalmazott prednizon-kezelés között . Továbbá, az immunszuppresszív és biológiai terápiák drágák, és a súlyos mellékhatások felméréséhez gondos kezelés előtti értékelést, valamint a vérvizsgálat gyakori nyomon követését igényli.
krónikus-visszatérő stádiumban a gyakori kiújulás a kortikoszteroid-kezeléssel szembeni rezisztenciára utalhat, és szteroid-megtakarító immunmoduláló kezelésre utalhat . A szteroid-rezisztens kiújulás vagy szteroid-intolerancia előnyös szere a ciklosporin . Az Infliximab, a rituximab, az adalimumab és az interferon alfa-2a olyan biológiai szerek, amelyeket VKH-betegségben refrakter uveitis kezelésére is alkalmaztak.
az akut VKH-vel gyakran összefüggő elülső uveitis kezelésére lokális szteroidokat (pl. prednizolon-acetát 1%) és lokális cyloplegiát (pl. ciklopentolát 1% vagy atropin 1%) kell előírni az elülső kamra gyulladásának mértékétől függően.
a szemészeti szövődmények gyakran társulnak a VKH-betegséghez. Tekintettel a VKH-val kezelt betegek több szakaszára és különböző prezentációira, a kezelés sok esetben késhet. A VKH súlyos formáiban és a kiújulásokban az intraokuláris gyulladás nehezen szabályozható, és szerkezeti károsodást okozhat. A betegek több mint 50% – ánál alakulnak ki kapcsolódó szövődmények, beleértve a szürkehályogot, a másodlagos glaukómát, a koroid neovaszkuláris membránokat, a szubretinális fibrózist vagy ezek kombinációját (6 .ábra).
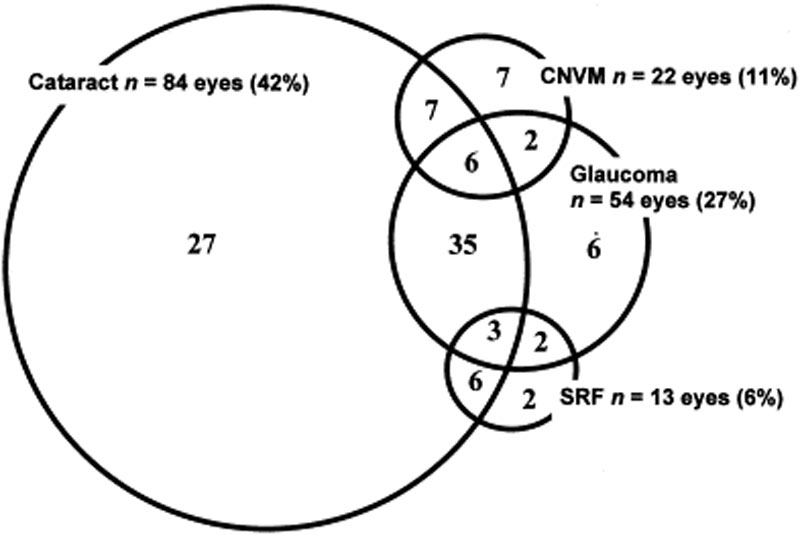
6. ábra: Venn diagram, amely VKH-s betegek szövődményeit mutatja. (Az Am J Ophthalmol engedélyével használják. 2001;131(5):599-606 )
epidemiológia és etiológia
|
SIGNS
|
TÜNETEK
|
KEZELÉS/MENEDZSMENT
|
- Du L, Kijlstra A, Yang P. Vogt-Koyanagi-Harada betegség: újszerű betekintést kórélettani, diagnózis és kezelés. Prog Retin Eye Res 2016; 52: 84-111. https://PubMed.gov/26875727. DOI: 10.1016 / j.2016.02.002
- Yamaki K, Gocho K, Hayakawa K, Kondo I, Sakuragi S. tyrosinase a családi fehérjék a Vogt-Koyanagi-Harada betegségre jellemző antigének. J Immunol 2000;165(12):7323-7329. https://PubMed.gov/11120868
- Horie Y, Takemoto Y, Miyazaki A, Namba K, Kase S, Josida K, Ota M, Hasumi Y, Inoko H, Mizuki N, Ohno S. A tirozináz géncsalád és a Vogt-Koyanagi-Harada betegség japán betegeknél. Mol Vis 2006;12:1601-1605. https://PubMed.gov/17200659
- Ng JY, Luk FO, Lai TY, Pang CP. A molekuláris genetika hatása a Vogt-Koyanagi-Harada betegségben. J Szemészeti Inflamm Fertőz 2014; 4:20. https://PubMed.gov/25097674. DOI: 10.1186 / s12348-014-0020-1
- Bowling B. Uveitis. Kanski klinikai szemészet New York, New York: Elsevier; 2016; fejezet 11; p. 395-465.
- Yeh PT YC, Yang CH, Lin CP. Nem Rhegmatogén Retina Leválás. A: Schachat AP SS, Hinton DR, Wilkinson CP, Wiedemann P,, szerkesztő. Ryan retinája. New York: Elsevier; 2018; fejezet 99; p. 1828-1849.
- Goto H RK, Rao N. Vogt-Koyanagi-Harada betegség. In: Schachat AP SS, Hinton DR, Wilkinson CP, Wiedemann P, szerkesztő. Ryan retinája. New York, New York: Elsevier; 2018; fejezet 78; p. 1505-1515.
- Riddington L, Hall aj, Tait B, Nicholson I, Varney M. Vogt-Koyanagi-Harada szindróma vietnami származású betegeknél. Aust N Z J Szemészeti 1996;24(2): 147-149. https://PubMed.gov/9199747
- Sugita S, Takase H, Kawaguchi T, Taguchi C, Mochizuki M. A tirozináz peptidek és a cytomegalovírus antigén T-sejtek közötti keresztreakciója Vogt-Koyanagi-Harada betegségben szenvedő betegektől. Int 2007;27 (2-3): 87-95. https://PubMed.gov/17253112. DOI: 10.1007 / s10792-006-9020-y
- Freund BK SD, Mieler WF, Yannuzzi LA. Gyulladás. A Retina Atlasz. New York, New York: Elsevier 2017; fejezet 4; p. 279-398.
- Rao N. Vogt-Koyanagi-Harada betegség. In: J YMaD, szerkesztő. Szemészet. New York, New York: Elsevier; 2014; fejezet 7.17; p. 761-763.
- Rao NA, Xu S, Font RL. Szimpatikus szemészet. Az epithelioid és az óriássejtek immunhisztokémiai vizsgálata. Szemészet 1985;92(12):1660-1662. https://PubMed.gov/4088616
- nussenblatt RB. Vogt-Koyanagi-Harada Szindróma. In: Whitcup RBNaSM, szerkesztő. Uveitis: alapismeretek és klinikai gyakorlat. 4. kiadás ed: Elsevier; 2010; fejezet 24.
- Read RW, Holland GN, Rao NA, Tabbara KF, Ohno S, Arellanes-Garcia L, Pivetti-Pezzi P, Tessler HH, Usui M. Revised diagnostic criteria for Vogt-Koyanagi-Harada disease: report of an international committee on nómenklature. Am J Szemészeti 2001;131 (5): 647-652. https://PubMed.gov/11336942
- Chung H, Choi DG. Az uveitis klinikai elemzése. Koreai J. 1989;3 (1): 33-37. https://PubMed.gov/2795939. DOI: 10.3341 / kjo.1989.3.1.33
- Abu El-Asrar AM, Al-Kharashi AS, Aldibhi H, Al-Fraykh H, kangave D. Vogt-Koyanagi-Harada betegség gyermekeknél. Szem (Lond) 2008;22(9):1124-1131. https://PubMed.gov/17479116. DOI: 10.1038 / sj.szem.6702859
- Martin TD, Rathinam SR, Cunningham ET. A dél-indiai Vogt-Koyanagi-Harada-betegségben szenvedő gyermekeknél a prevalencia, a klinikai jellemzők és a látásvesztés okai. Retina 2010;30(7):1113-1121. https://PubMed.gov/20168275. DOI: 10.1097 / IAE.0b013e3181c96a87
- Forster DJ, Green RL, Rao NA. A Vogt-Koyanagi-Harada szindróma egyoldalú megnyilvánulása egy 7 éves gyermekben. Am J. 1991;111(3): 380-382. https://PubMed.gov/2000916
- Yamamoto Y, Fukushima a, Nishino K, Koura Y, Komatsu T, Ueno H. Vogt-koyanagi-harada betegség 68-89 éves idős betegeknél. Jpn J Ophthalmol 2007; 51 (1): 60-63. https://PubMed.gov/17295144. DOI: 10.1007 / s10384-006-0379-0
- Wang Y, Chan CC. Nemi különbségek a vogt-koyanagi-harada betegségben és a szimpatikus szemészetben. J Ophthalmol 2014;2014: 157803. https://PubMed.gov/24734166. DOI: 10.1155/2014/157803
- Nakao K, Abematsu N, Mizushima Y, Sakamoto T. Invest Ophthalmol Vis Sci 2012; 53 (4): 1917-1922. https://PubMed.gov/22408010. DOI: 10.1167 / iovs.11-8984
- Rao NA, Gupta A, Dustin L, Chee SP, Okada AA, Khairallah M, Bodaghi B, Lehoang P, Accorinti M, Mochizuki M, Prebriputaloong t, Read RW. A Vogt-Koyanagi-Harada-betegség megkülönböztető klinikai jellemzőinek gyakorisága. Ophthalmology 2010;117(3):591-599, 599.e591. https://PubMed.gov/20036008. DOI: 10.1016/j.ophtha.2009.08.030
- Veerappan M, Fleischman D, Ulrich JN, Stinnett SS, Jaffe GJ, Allingham RR. The Relationship of Vogt-Koyanagi-Harada Syndrome to Ocular Hypertension and Glaucoma. Ocul Immunol Inflamm 2017;25(6):748-752. https://PubMed.gov/27438521. DOI: 10.1080/09273948.2016.1189578
- Baltmr A, Lightman S, Tomkins-Netzer O. Vogt-Koyanagi-Harada syndrome – current perspectives. Clin Ophthalmol 2016;10:2345-2361. https://PubMed.gov/27932857. DOI: 10.2147/OPTH.S94866
- Kitaichi N, Matoba H, Ohno S. az ágyéki punkció pozitív szerepe a Vogt-Koyanagi-Harada-betegség diagnózisában: a limfocita részhalmaza a vizes humorban és a cerebrospinális folyadékban. Int Szemészeti 2007;27(2-3):97-103. https://PubMed.gov/17211585. DOI: 10.1007 / s10792-006-9016-7
- Oshima Y, Harino S, Hara Y, Tano Y. Indocianin zöld angiográfiai eredmények a Vogt-Koyanagi-Harada-betegségben. M. J. 1996;122(1): 58-66. https://PubMed.gov/8659599
- Read RW, Yu F, Accorinti M, Bodaghi B, Chee SP, Fardeau C, Goto H, Holland GN, Kawashima H, Kojima E, Lehoang P, Lemaitre C, Okada AA, Pivetti-Pezzi P, Secchi a, See RF, Tabbara KF, Usui M, Rao NA. Az akut Vogt-Koyanagi-Harada-betegségben a kortikoszteroidok beadási módjára gyakorolt hatás értékelése. Am J Szemészeti 2006;142(1): 119-124. https://PubMed.gov/16815259. DOI: 10.1016 / j.ajo.2006.02.049
- Rubsamen PE, Gass JD. Vogt-Koyanagi-Harada szindróma. Klinikai tanfolyam, terápia és hosszú távú vizuális eredmény. Arch Oftalmol 1991;109(5):682-687. https://PubMed.gov/2025171
- Urzua CA, Velasquez V, Sabat P, Berger O, Ramirez S, Goecke A, Vásquez DH, Gatica H, Guerrero J. a korábbi immunmoduláló kezelés jobb vizuális eredményekkel jár a Vogt-Koyanagi-Harada betegségben szenvedő betegek egy alcsoportjában. Acta Ophthalmol 2015; 93(6): e475-480. https://PubMed.gov/25565265. DOI: 10.1111 / aos.12648
- Read RW, Rechodouni A, Butani N, Johnston R, LaBree LD, Smith RE, Rao NA. A Vogt-Koyanagi-Harada-betegség szövődményei és prognosztikai tényezői. Am J Szemészeti 2001;131 (5): 599-606. https://PubMed.gov/11336934
Mai AP, Tran C, Wilson CW, Fox AR, Boldt HC. Vogt-Koyanagi-Harada (VKH) betegség. EyeRounds.org. Április 1, 2019. Elérhető a http://EyeRounds.org/cases/284-vogt-koyanagi-harada.htm
Leave a Reply