kovalens vegyületek
most van egy rövid ötlete arról, hogy a különböző elemek miért viselkednek másképp. De tudod, egy nagy része ez azért van, mert a “természet” a kötések a vegyületek. Csakúgy, mint te és a legjobb barátaid, számos különbség van a “belső” tulajdonságok miatt, így van ez az ionos és kovalens vegyületek esetében is. Ebben a fejezetben többet fogunk megtudni a kovalens vegyületek fogalmáról,megvizsgáljuk azok tulajdonságait.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Ennek oka az, hogy a kovalens molekulák atomjai nagyon szorosan össze vannak szorítva. Minden molekula valóban teljesen különálló, és a kovalens vegyület egyes molekulái közötti vonzerő általában gyenge.
nagyon kevés energiát igényel a molekulák elválasztása. Ez azért van, mert a molekulák között vonzó erők vannak a teljes elektromos töltés hiányában. A kovalens vegyületek általában gáznemű molekulák szobahőmérsékleten és nyomáson. Ezek lehetnek alacsony, viszonylag alacsony forráspontú folyadékok is.
ezek a jellemzők a gyenge intermolekuláris erőknek tulajdoníthatók, amelyek ezeket az atomokat együtt tartják. Ugyanakkor sok szilárd kovalens vegyület is van. Alacsony olvadáspontjuk van. Érdekes azonban megjegyezni, hogy ezeknek egy kis száma teljesen más szerkezettel rendelkezik. Hatalmas struktúrákat alkotnak, ahol hatalmas számú atomot tartanak össze. Ez a megosztott elektronok jelenléte miatt lehetséges.
Ezek az óriási molekuláris struktúrák alapvetően olyan molekulákból álló rácsok, amelyeket kovalens kötések szerkezete tart össze. Ezek a kovalens kötések nagyon erősek. Ezek általában nagyon kemények, magas olvadáspontokkal, amelyek különböznek a kovalens vegyületek többségétől. Az ilyen kovalens vegyületek közé tartozik a szénatomhálózat gyémánt és grafitja. Ezek közé tartozik a szilícium-dioxid és az oxigénatomok hálózata is.
Letöltés Kémiai Kötés puskát PDF kattintva a Letöltés gomb alatt,


Böngésszen több Téma szerinti Kémiai Kötés, Valamint a Molekuláris Szerkezet
- Bond Paraméterek
- Alapjai Kémiai Kötés
- Hibridizáció
- Hidrogén Kötés
- Ionos vagy Electrovalent Vegyületek
- Molekuláris Orbitális Elmélet
- Polaritás Kötvények
- Rezonancia Szerkezetek
- Valence Bond Elmélet
- VSEPR elmélet
A kovalens vegyületek általános tulajdonságai
- kovalens vegyületek általában alacsony olvadáspontúak. Ez alól kivételt képeznek a szilícium-dioxid és a gyémántok molekulái, amelyek magas olvadásponttal rendelkeznek.
- ezeknek a vegyületeknek alacsony forráspontjuk van. Ez annak tulajdonítható, hogy a különböző kötésű atomok közötti gyenge vonzerejük van. Van Der Waals erők kötődnek ezek az atomok.
- ezek a vegyületek általában alacsony forráspontú és olvadáspontú gázok és folyadékok.
- a szilárd kovalens vegyületek lágy szerkezetűek, mint a grafit. Ez azért van, mert az elektronok felhője jelen van a szénatomok minden rétege között.
- ezek a vegyületek nem elektromos töltésű vezetők. Ennek fő oka a töltött ionok hiánya. Kivétel ez alól a grafit, ahol elektronok felhőjét látjuk. Ezek a grafit jó karmesterré teszik.
- ők is rossz hővezetők. Molekuláikban nincsenek szabad elektronok, ami akadályozza a hőenergia áramlását.
- a kovalens vegyületek általános tulajdonságként nem rendelkeznek poláris jellemzőkkel. Ezért ezek a vegyületek vízben oldhatatlanok. A vízmolekulák nem teljesen semlegesek, enyhe negatív töltéssel rendelkeznek az oxigénatomon, és enyhe pozitív töltéssel rendelkeznek a hidrogénatomokon, és mivel a kovalens vegyületek semleges molekulákból vagy kis töltésű molekulákból állnak, ezért nem vonzódnak erősen a vízmolekulákhoz.
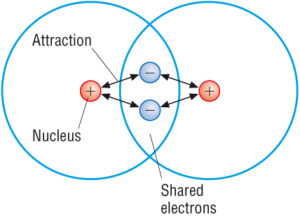
(forrás: Google)
fizikai és kémiai tulajdonságok
- a folyékony kovalens vegyületek elpárolognak. Ez azt jelenti, hogy a folyadékok és szilárd anyagok molekulái a felszínükről a levegőbe veszítenek.
- ezek a vegyületek molekuláik között nagyon kisebb affinitással rendelkeznek.
- különböző kovalens vegyületek saját jellegzetesen alakú molekulákkal rendelkeznek. A kötések előre beállított szögekre irányulnak.
- egyes vegyületek, különösen a gyógyszerek vízben oldódnak. A többi olajban oldódik.
- a kovalens vegyületek többsége nem poláris, vagy nagyon kevéssé hajlamos arra, hogy teljesen szétváljon, hogy ionokat képezzen, ezért soha nem vezet villamos energiát.
- normál hőmérsékleten és nyomáson ezeket a vegyületeket folyadékként vagy gázként találjuk. De vannak szilárd anyagok is, és nagyobb molekulatömegük van.
- a kovalens vegyületek kristályai kétféle: az egyik, hogy gyenge van der Waal erő tartja ezeket együtt, mint a jód. Ezek könnyen olvaszthatók és illékonyak, a másiknak nagy atomhálózata van, amely a makromolekulákat állítja fel.
- ezek a vegyületek szerves oldószerekben, például éterben és benzolban oldódnak.
- a kovalens kötések irányított jellegűek. Ezért az izomerizmus jelenségét mutatják.
- a kovalens vegyületek általában nagyon lassú reakciósebességgel rendelkeznek, ellentétben a különböző Ionos vegyületekkel.
megoldott példák az Ön számára
kérdés: miért nem oldódnak a kovalens vegyületek vízben?
válasz: a vízmolekulák nem teljesen semlegesek. Ezeknek a molekuláknak az oxigénatomon enyhe negatív töltése van, a hidrogénatomokon pedig enyhe pozitív töltése van. Másrészt tudjuk, hogy a kovalens vegyületek semleges molekulákból vagy molekulákból állnak, enyhe töltéssel. Ez az oka annak, hogy ezek a vegyületek nem vonzódnak erősen a vízmolekulákhoz.
Leave a Reply