Kémiai kötés
a kémiai kötések azok az atomok közötti látnivalók, amelyek együtt tartják őket, hogy vegyületeket képezzenek. A kötésnek három fő típusa van: kovalens kötések, amelyek molekuláris vegyületeket kötnek össze, ionos kötések, amelyek sókat és Ionos kristályokat kötnek, valamint fémkötések, amelyek megkötik a fémek atomjait.
molekulák és kovalens kötések
a legtöbb üzemanyag, műanyag és természetes termék molekulavegyületek, amelyek molekulákba kötött atomokból állnak. A molekula atomjait összekötő kötés típusa kovalens kötés, amely akkor fordul elő, amikor két atom külső elektronjai megosztódnak közöttük, vonzerőt teremtve a két atom között.
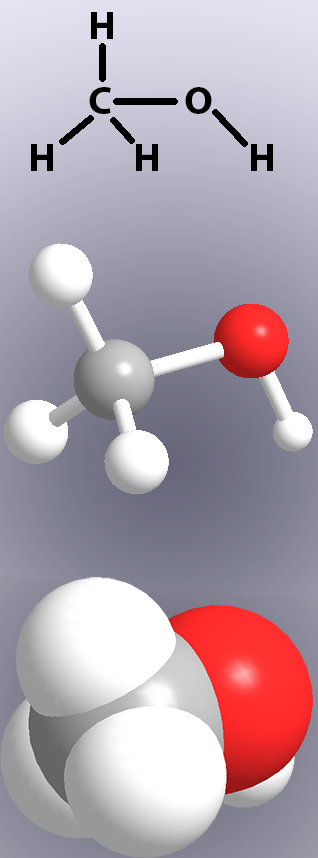
a kovalens kötéseket a kémiai szerkezetekben vonalak (1.ábra, felső rész), a modellekben pedig “botok” vagy az atomok átfedése (1. ábra, középső és alsó rész) mutatja.
a kovalens kötésben lévő elektronok nem mindig egyenlően oszlanak meg a két atom között. Ha a megosztás egyenlőtlen, az egyik atom nagyon enyhe pozitív töltéssel rendelkezik, a másik atom pedig kissé negatív lesz. Ez egy kis elektromos dipólt tartalmaz-a dipólust tartalmazó molekulák poláris vegyületek. Az, hogy egy molekula poláris vagy nem poláris, befolyásolja annak tulajdonságait, például az olvadás-és forráspontokat, valamint a hidrogénkötést.
Tudjon meg többet a kovalens kötésről a kémia Librettáján.
Ionos és fémes kötés
míg a kovalens kötés magában foglalja az elektronok két atom közötti megosztását, az ionos kötés magában foglalja az elektronok teljes átvitelét az egyik atomról a másikra, pozitív és negatív ionokat hozva létre. Ezeket az ionokat ezután az ellenkező töltések közötti vonzás tartja össze. Az ionos vegyületek kristályokat képeznek ezen látnivalók alapján.
A fémkötés magában foglalja a fématomok vegyértékű elektronjainak teljes megosztását, létrehozva egy “elektrontengert”, amelyben az elektronok szabadon mozoghatnak. Ez a fémek magas vezetőképességének oka. További információ a fémes kötésről a kémiai Librettext
Energia és kémiai kötések
általában az energia felszabadul, amikor két atom között kötés alakul ki, függetlenül attól, hogy milyen típusú kötés. Hasonlóképpen, ha két atom között már létezik kötés, energiára lesz szükség annak megtöréséhez. A kötés megszakításához szükséges energia mennyisége megegyezik a felszabaduló energia mennyiségével.
a legtöbb kémiai reakció magában foglalja mind a kémiai kötések törését, mind előállítását. Ha az új kötések kialakításával felszabaduló energia nagyobb, mint a “régi” kötések megszakításához szükséges energia, akkor az energiát a reakció összességében felszabadítja. Ez az energia elveszhet, mint a hő, vagy lehet használni a hatalom.
például a metán (CH4) égése követi ezt a kémiai reakciót:
Ez a reakció magában foglalja a metánban lévő négy szén-hidrogén kötés és az O2 oxigén-oxigén kötés megszakítását. Az új kötések a két szén-oxigén kötés (CO2-ben) és a hidrogén-oxigén kötések (H2O-ban). Ezek az új kötvények összességében kevesebb energiával rendelkeznek, mint az eredeti kötvények, így az energia felszabadul ezzel a reakcióval. Az energia felszabadítása az égési reakciók jellemzője-lehet, hogy ezt észrevette, amikor forró lángot érez. Az alábbi animáció a metán szénhidrogén-elégetését szemlélteti.
mivel nagy mennyiségű energia szabadul fel a CO2 és a H2O szénhidrogének, például a metán elégetésekor, ezek jó elsődleges energiaforrás. Ez azt is jelenti, hogy nagy mennyiségű energiára lenne szükség a kötések CO2-ben való megtöréséhez és más molekulák kialakításához. Ez az egyik oka annak, hogy a fotoszintézis annyi energiát igényel (napfénytől), hogy a CO2-t szénhidrátokká alakítsa.
további olvasáshoz
- kémiai energia
- égés
- elsődleges energia
- energiaátalakítási technológia
- vagy fedezze fel a véletlenszerű oldalt
Leave a Reply