Kémia: mik azok a savak és bázisok?
mik azok a savak és bázisok?
bár már mondtam, hogy a savakat és bázisokat nem nehéz megérteni, rossz hírem van: nem egy, hanem három közös definíció van a savak és bázisok leírására: Arrhenius savak és bázisok, Brnsted-Lowry savak és bázisok, valamint Lewis savak és bázisok. Bár ez úgy hangzik, mintha meg kell tanulni a savak és bázisok háromszor, a jó hír az, hogy számos gyakorlati célra, ez a három meghatározás nagyjából egyenértékű.
Arrhenius savak és bázisok
az 1800-as évek végén régi barátunk, Svante Arrhenius a savak és bázisok meghatározásával állt elő, miközben kinetikai problémákon dolgozott.
Arrhenius szerint a savak olyan vegyületek, amelyek vízben felbomlanak, hogy hidrónium (H+) ionokat bocsátanak ki. Az Arrhenius-sav gyakori példája a sósav (HCl):
- HCl ? H + + Cl-
a savak képletei általában hidrogénnel kezdődnek, bár a szerves savak figyelemre méltó kivétel. A nevek, képletek valami közös a savak az alábbi táblázat mutatja:
| Sav Neve | Képlet |
|---|---|
| sósav | HCl |
| salétromsav | HNO3 |
| foszforsav | H3PO4 |
| kénsav | H2SO4 |
| ecetsav | C2H4O2 |
Arrhenius bázisok meghatározott vegyület okozza a kialakulását a-hidroxid-ion, mikor kerül a vizet. Az Arrhenius-bázis egyik példája a nátrium-hidroxid (NaOH):
- NaOH ? Na + + OH –
bázisok jellemzően ” OH ” a képletek, bár vannak kivételek. Például az ammónia (NH3) nem tartalmaz hidroxidionokat, hanem akkor képezi őket, amikor vízzel reagál:
- NH3 + H2O ? NH4 + + OH –
egyes közös bázisok nevei és képletei a következő táblázatban találhatók:
| Alap Neve | Képlet |
|---|---|
| ammónia | NH3 |
| kálium-hidroxid | KOH |
| nátrium-hidrogén-karbonát | NaHCO3 |
| nátrium-karbonát | na2co3-ként |
| nátrium-hidroxid | NaOH |
Egy-oxidok formájában savak vagy bázisok, amikor a víz egészül ki. Mivel ezek a vegyületek nem tartalmaznak H+ vagy OH – ionokat, hacsak nem reagálnak vízzel, “anhidrideknek” nevezik őket.”A nemfémek oxidjai jellemzően savas anhidridek (vízben való elhelyezésükkor savat képeznek), a fémek oxidjai pedig bázisanhidridek (vízben való elhelyezéskor bázist képeznek).
Brnsted-Lowry savak és bázisok
az 1900-as évek elején Johannes Brnsted és Thomas Lowry egy alternatív meghatározást javasolt savakra és bázisokra, hogy az ammónia semlegesítse a HCl savasságát akkor is, ha nincs víz. Ez a jelenség megmutatta nekik, hogy az ammónia alap, még akkor is, ha nincs víz körül, hogy hidroxidionokat képezzen.
a hidrónium-ion leírására számos különböző nevet és képletet használnak. Bár a képletet korábban “H+” – ként mutatták be, néha “H3O” – ként írják, mert ez az ion képződik, amikor a H+ vízzel kombinálódik. A hidroniumionokra való hivatkozás másik gyakori módja az, hogy csak “protonoknak” nevezzük őket.”Ez a név abból a tényből származik, hogy a H+ egy hidrogénatomot (egy protont és egy elektronot) képvisel, amely elvesztette elektronját, csak a csupasz protont hagyva hátra.
a Brnsted-Lowry sav olyan vegyület, amely hidroniumionokat ad egy másik vegyületnek?például a sósav H + ionokat ad azoknak a vegyületeknek, amelyekkel reagál. Brnsted-Lowry bázisok olyan vegyületek, amelyek elfogadják a hidrónium-ionokat?amikor az ammónia hidrónium-iont kap a HCl-ből, az ammónium-iont képez.
a következő egyenlet egy Brnsted-Lowry sav reakcióját jelenti Brnsted-Lowry bázissal:
- HNO3 + NH3 ? NO3 – + NH4 +
ebben a reakcióban a salétromsav savként viselkedik, mert protont ad az ammóniának. Az ammónia bázisként viselkedik, mert elfogadja a protont a salétromsavból.
azonban, ha megnézzük az egyenlet másik oldalát, megtaláljuk a nitrát-és ammóniumionokat. Mivel a nitrát ion képes elfogadni protonok az ammónium-ion (alkotnak HNO3), a nitrát ion egy nagyon gyenge Brnsted-Lowry bázis. Mivel az ammóniumionnak van egy extra protonja (ebben az esetben a nitrátionnak), ez egy Brnsted-Lowry sav.
a nitrátion a salétromsav molekulán alapul, tehát azt mondjuk, hogy ez a salétromsav konjugált bázisa. Hasonlóképpen, az ammónium-ion az ammónia konjugált savja. A konjugált bázissal (például HNO3 és NO3-) vagy konjugált savval (például NH3 és NH4+) rendelkező savat együttesen konjugált sav-bázis párnak nevezzük.
Lewis savak és bázisok
a savak és bázisok Brnsted-Lowry definíciójában a bázist olyan vegyületként definiálják, amely képes elfogadni egy protont. Hogyan fogadja el azonban a protont?
az egyik jellemzője, hogy a Brnsted-Lowry bázisok közösek egymással, az, hogy nem osztott elektronpárjuk van. Amikor egy hidrónium-ion vándorol a molekula mellett, néha a magányos Párok kinyúlnak és megragadják. Erre példa az, amikor az ammónia savas oldatban Elfogad egy protont:
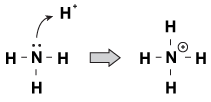
23.1. ábra az ammónia egyetlen elektronpárjával a salétromsavból származó protont képes megragadni.
ennek a folyamatnak az egyik módja az, hogy az ammónia atom magányos párját a protonnak adományozza. Mivel a magányos Párok vezetik ezt a kémiai reakciót, új definíciónk van a savasságra és a bázikusságra, az úgynevezett “Lewis savasság/bázikusság.”A Lewis-bázis olyan vegyület, amely egy elektronpárt adományoz egy másik vegyületnek (példánkban az ammónia). A Lewis-sav olyan vegyület, amely elfogadja az elektronpárt (példánkban a H+ ion).
Lewis bázisok olyan vegyi anyagok, amelyek elektronpárokat adhatnak. A Lewis-savak olyan vegyi anyagok, amelyek elfogadják őket.
bár a példánkban egy magányos párnak egy protont adományoztunk, az ammónia magányos párja sok más vegyülettel is reagálhat. Az ammónia például a következő eljárással adományozhatja magányos elektronpárját a BH3-nak:

23.2 ábra az ammónia magányos párja a BH3-hoz kapcsolódik.
ebben a folyamatban az ammónia a Lewis-bázis, a BH3 pedig a Lewis-sav.
általában a savak és bázisok Lewis-definíciója a leghasznosabb, mert a három meghatározás közül a legintenzívebb. Például, a sav Brnsted-Lowry definíciója magában foglalja a HF-t, de nem a BH3-t, amely nem veszíti el a protont, ha a magányos Párok Lewis bázison kapcsolódnak.
részlet Ian Guch teljes idióta kémiai útmutatójából 2003. Minden jog fenntartva, beleértve a reprodukciós jogot egészben vagy részben bármilyen formában. Által használt megállapodás Alpha Books, tagja Penguin Group (USA) Inc.
ahhoz, hogy ezt a könyvet közvetlenül a kiadótól Rendelje meg, látogasson el a Penguin USA webhelyére, vagy hívja az 1-800-253-6476 telefonszámot. Ezt a könyvet a következő címen is megvásárolhatja Amazon.com és Barnes & Noble.
Leave a Reply