Epigenetika-nem csak a gének teszik minket
Tehát mi az epigenetika?
az epigenetika másik módja ilyen; míg a hagyományos genetika leírja, hogy génjeink DNS-szekvenciáit hogyan továbbítják egyik generációról a másikra, az epigenetika leírja a gének használatának módját. Ahhoz, hogy számítógépes analógiát alkossunk, gondoljunk az epigenetikára, mint metaadatokra, az alapul szolgáló adatokat leíró és Megrendelő információkra. Ha például MP3 lejátszóval rendelkezik, akkor sok adatot, az MP3 fájlokat tartalmaz. Gondolj ezekre úgy, mint a génekhez hasonló. De akkor is valószínűleg lejátszási listákat, vagy lehet játszani számokat művész vagy műfaj. Ez az információ, lejátszási lista, előadó, műfaj stb. a metaadatok. Meghatározza, hogy mely számokat játsszák, milyen sorrendben, és ez az, amit az epigenetika a genetikához. Ez egy sor olyan folyamat, amely hatással van a gének bekapcsolására vagy” expresszálására”, amint azt a molekuláris biológusok mondanák.
hogyan működik az epigenetika?
tehát az epigenetika arról szól, hogyan fejezik ki és használják a géneket, nem pedig maguk a gének DNS-szekvenciáját,de hogyan működik ez? Számos kutató tanulmányozta az epigenetikát az elmúlt évtizedekben, és jelenleg az intenzív kutatási tevékenység területe. Tudjuk, hogy az epigenetika működésének egy része a kis kémiai címkék DNS-hez való hozzáadásával és eltávolításával történik. Úgy gondolhat ezekre a címkékre, mint a post-megjegyzi, hogy kiemelik az egyes géneket azzal a információval, hogy be kell-e kapcsolni vagy ki kell-e kapcsolni őket. Valójában a szóban forgó kémiai címkét metilcsoportnak nevezik (Lásd az 1. ábrát), és a négy bázis vagy “kémiai betűk”, A, C, T és G egyikének módosítására használják, amely a DNS genetikai kódját alkotja. A címkézett betű C vagy citozin, módosításakor vagy metilálásakor 5-metil citozin. A metilcsoportokat DNS-metiltranszferázoknak (DNMTS) nevezett enzimek adják a DNS-hez.
-
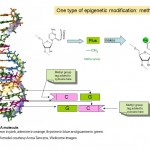
1.ábra. Két kémiai tag, metil és acetil csoport, amelyek központi szerepet játszanak az epigenetikai jelenségekben, valamint a citozin és az 5-metil citozin kémiai szerkezete a DNS-ben. A molekula ötszögletű része képezi a DNS folyamatos “gerincét”. Csak a DNS két szálának egyike látható, amely az ismerős kettős hélixet alkotja.
a Méhkirálynő státuszt részben kevesebb metilcímke határozza meg
a legtöbb esetben a gén DNS-jében metilált Cs-K kikapcsolják a gént. A mézelő méhek jó példát mutatnak nekünk arról, hogy ez hogyan működhet. A dolgozó méheknek és a királynőnek nagyon különböző testük van; a királynő sokkal nagyobb, hosszabb élettartamú, megnagyobbodott hassal rendelkezik, és több ezer tojást rak, míg a kisebb munkások sterilek, de összetett takarmányozási és kommunikációs készségekkel rendelkeznek. Ennek ellenére a királynő és a kaptárban dolgozók nők és genetikailag azonosak. A nyom, hogy ez hogyan jön létre abban rejlik, méhpempő, a váladék, amely táplálja néhány fejlődő lárvák, és amelynek eredményeként ezek a lárvák egyre királynők helyett dolgozók. Vissza fogunk jönni, hogy a méhpempő, valamint a királynő -, hogy a tulajdonságok később, de egy lenyűgöző darab kutatás kimutatta, hogy ha az összeg a metil-csoport hozzáadása DNMT enzim mesterségesen csökkenteni a méh lárvák, majd a lárvák fejlődött, queens, még akkor is, ha nem fed a méhpempő. Így a királynő és a munkás közötti váltást megfordíthatja a méhlárvák DNS-ében található metilcímkék bősége. Kevesebb metilcímke vezet egy speciális gén vagy gének bekapcsolásához a fejlődő lárvákban, ami a lárvák királynővé alakulását eredményezi, nem pedig a munkavállalókat.
címkék farok is működik génkapcsolók
DNS metil címkék csak egy része a történet, bár. Minden növény és állat sejtjeiben a DNS-t nukleoszómákba csomagolják vagy csomagolják, ahol a DNS kettős spirálját a fehérje központi magja köré tekerik (lásd a 2.ábrát). Körülbelül 150 betűnyi DNS-t (vagy bázispárokat) csomagolnak minden nukleoszóma köré, ez segít a 3 milliárd bázispár genetikai kódjának minden sejtbe történő csomagolásában. A nukleoszómák túl kicsik ahhoz, hogy hagyományos mikroszkópokkal láthassák őket, de a biológusok Röntgendiffrakciónak nevezett technikát alkalmaznak az objektumok, például a nukleoszómák alakjának és szervezésének kidolgozására, és 1997-ben ez a technika nagy felbontásban feltárta a nukleoszómák gyönyörű szerkezetét – lásd (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
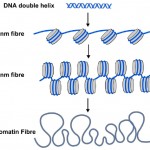
2.ábra. Az ismert DNS kettős spirál (kék) a sejtekben lévő nukleoszómák (szürke hengerek) köré van tekerve. A nukleoszómák húr vastagabb szálakká alakítható, amit 30 nm-es rostnak nevezünk, és ezt tovább lehet tekerni még vastagabb kromatinszálakká. Amikor a géneket bekapcsolják a nukleoszómájukba, jobban bevonódnak,mint a 10 nm-es rost.
a Nukleoszómák tömörek, de a nukleoszómát alkotó fehérjék végei vagy “farkai”, amelyeket hisztonoknak neveznek, kiemelkednek az egyébként kompakt nukleoszóma szerkezetből. A DNS metilcímkéihez hasonlóan kis kémiai címkék is hozzáadhatók ezekhez a hiszton farokhoz (lásd a 3. ábrát). Az ezekhez a farokhoz hozzáadott kémiai címkék közül kettő acetilcsoport és metilcsoport. Számos kombinációban metil, acetil és néhány más típusú címke adható a farokhoz, és ez hatással van arra, hogy egy mögöttes gént be-vagy kikapcsolnak-e. Valójában a géneket azonnal ki lehet kapcsolni (ezt hívják hangtompításnak), be lehet kapcsolni, vagy valahol a DNS-metilcímkék és a hiszton farokcímkék között. A DNS-és hisztoncímkék kombinációja azt is befolyásolhatja, hogy egy gén milyen könnyen be-vagy kikapcsolható.
-
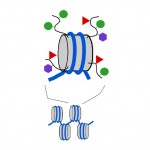
3.ábra. Kémiai címkék adhatók hozzá a nukleoszómákat alkotó hiszton fehérjék “farkához”. Szürke henger, nukleoszóma; ívelt fekete vonalak, hiszton farok; zöld körök, metil-címkék; piros háromszögek, acetil címkék; mályva hatszögek, más típusú címke.
Ha a sejtosztódás
Ha a sejtosztódás, a teljes DNS-szekvencia az eredeti cella (3 milliárd bázispár szereplő 23 pár kromoszóma van egy emberi sejt) duplázott, így mindkét lánya sejtek kap egy pontos másolat. Mi történik az epigenetikus címkékkel? Egy ideje tudjuk, hogy a DNS-metil-címkéket is lemásolják, így mindkét lánysejtnek ugyanaz a DNS-metilációs mintája van. Most már tudjuk, hogy a hisztoncímkék mintája is többnyire duplikálódik, mivel a sejtek osztódnak, bár ez jelenleg kevésbé ismert. Mindazonáltal a sejtosztódás olyan idő is, amikor az epigenetikus címkék a legkönnyebben megváltoztathatók.
a hosszú élettartamú féreg visszatérése
közvetlenül az elején találkoztunk a hosszú élettartamú mikroszkopikus férgek történetével, még akkor is, ha az egyes utódok nem öröklik azt a variáns gént (mutációt), amely eredetileg a meghosszabbított élettartamot okozta. Most abban a helyzetben vagyunk, hogy megmagyarázzuk ezt a látszólag furcsa eredményt. A legtöbb esetben a gének tartalmazzák a fehérjemolekula előállításához szükséges információkat, a fehérjemolekulák pedig olyan enzimek lehetnek, amelyek kémiai reakciókat végeznek a sejtben, vagy maga a sejt szerkezetének részei. Kiderül, hogy a féregvizsgálat során mutált gének olyan fehérjéket hoznak létre, amelyek együtt működnek, hogy metil-címkét adjanak a nukleoszómákhoz. Ez a címke egy on-switch. Amikor egy vagy több gén mutálódott, ez a címke hiányzott, és több olyan gén is be volt kapcsolva, köztük néhány, az öregedésben részt vevő, kikapcsolták, és a férgek élettartama hosszabb volt. A váratlan dolog az, hogy az epigenetikus címkéket úgy gondolták, hogy teljesen törlik vagy visszaállítják a sperma és a tojás kialakulása során, így ellentétben a génekkel, amelyeket nem szabad továbbadni a következő generációnak. De ez az eredmény és más kutatások, amelyek azt mutatják, hogy ez nem mindig így van, és hogy néha az epigenetikus címkék mintázata továbbadódik.
hogyan készítsünk királynőt
az, hogy egy lárva mézelő méh munkás vagy királynő lesz-e, egy epigenetikus kapcsolótól függ, és úgy tűnik, hogy ezt a kapcsolót a méhpempő “megfordítja”. De mi a helyzet a méhpempővel, amely olyan lárvát vezet, amely egyébként munkás lesz, hogy királynővé váljon? A válasz abban rejlik, hogy megértjük, hogy a nukleoszómák hiszton farkához hozzáadott egyedi kémiai címkéket a sejt folyamatosan felülvizsgálja. Az acetilcímkéket a hiszton-acetil-transzferázoknak nevezett enzimek adják hozzá, és azokat a hiszton-deacetilázok (HDACs) nevű enzimek egy második csoportja eltávolítja vagy törli. Mindkét enzim jelen van a legtöbb sejtben, ami lehetővé teszi a gének be – vagy kikapcsolását az idő múlásával.
Több acetil kategória segíteni méhkirálynő állapota
a Közelmúltban, a kutatók meghatározott azonosítani vegyületek a royal jelly, ami megváltoztatná ezt a folyamatot, mit találtak valami ismert, mint egy HDAC-gátló. Ez egy viszonylag egyszerű kémiai vegyület volt, amely jelen van a méhpempőben, és megállítja a Hdac enzimek működését, amelyek általában eltávolítják az acetilcímkéket a hisztonokból. Ez acetilcímkék felhalmozódását eredményezi a méhembriók sejtjeiben, és mint a korábban leírt DNS-metil-csoportok csökkenése, úgy gondolják, hogy ez bekapcsolja a királynő fejlődéséhez szükséges kulcsfontosságú géneket. A méhpempőben lévő HDAC-gátló nélkül a lárvák “alapértelmezett” genetikai utasításokat követnek, és dolgozókká alakulnak.
A HDAC-gátlók nemcsak a méhkirálynők számára fontosak, hanem egy kis, de egyre növekvő számú orvosilag hasznos gyógyszer részét képezik, amelyek epigenetikus címkéket céloznak meg, és amelyek hasznosak bizonyos típusú rák kezelésében. Továbbá a Hdac-k szerepe van abban is, hogy az agyunk emlékeket formál, és a hiszton acetilációt befolyásoló új gyógyszerek szerepet játszhatnak a jövőben az idős betegek memóriazavarának kezelésében.
A környezet epigenetics
láttuk, hogy a különbség a között, hogy egy királynő, munkás méh által meghatározott expozíció kémiai, hogy közvetlenül megváltoztatja epigenetikus kategória például az acetil-csoportok; de vannak példák, ahol a táplálkozás, vagy más szempontból a környezet hatással van az emberi populációk oly módon, hogy azzal magyarázható, hogy epigenetics? Nyilvánvaló, hogy nem végezhetünk kísérleteket az emberi populációkon, mint a mikroszkopikus férgeken vagy méheken, de néha az emberi történelem vagy a természeti jelenségek megteszik nekünk. Az egyik ilyen példa az úgynevezett Holland éhség tél. Az elmúlt évben a második világháború Európában, élelmiszer-embargó által bevezetett megszálló német erők a polgári lakosság Hollandia eredményezett súlyos éhínség, egybeesik egy különösen kemény tél. Körülbelül 20 000 ember halt meg éhen, mivel az adagok napi 1000 kilokalória alá estek. A háború káosza ellenére az orvosi ellátás és a feljegyzések sértetlenek maradtak, így a tudósok később tanulmányozhatták az éhínség emberi egészségre gyakorolt hatását. Azt találták, hogy azok a gyermekek, akik az éhínség idején az anyaméhben voltak, élethosszig növelték esélyeiket arra, hogy különböző egészségügyi problémákat fejlesszenek ki, mint az éhínség után fogant gyermekek. Ennek a hatásnak a legérzékenyebb periódusa a terhesség első néhány hónapja volt. Így úgy tűnik, hogy valami a méh fejlődésének korai szakaszában történik, amely életük hátralévő részében befolyásolhatja az egyént.
az epigenetikai hatások néha eljuthatnak az unokákhoz
még meglepőbb, néhány adat azt sugallja, hogy az éhség télen terhes nők unokái tapasztalják ezeket a hatásokat. Amit már megvitattunk, ez erősen epigenetikus mechanizmust sugall. Valójában a holland éhezés téli családjaival folytatott kutatások folytatódnak, és egy nemrégiben készült tanulmány, amely egy gént vizsgált IGF2-t vizsgált, a születés előtt éhínségnek kitett egyénekben a metil-címke alacsonyabb szintjét találta a gén DNS-ben. Bár az IGF2 önmagában nem vesz részt ezekben az emberekben a rossz egészségi állapot fokozott kockázatában, ez azt mutatja, hogy a születés előtt előállított epigenetikus hatások (azaz a metil-címkék számának csökkentése bizonyos géneken) évtizedekig tarthatnak. Az állatokon végzett vizsgálatok azt is megállapították, hogy az anya étrendje hatással lehet utódaira. Például, etetés bárány diéta hiányzik az a fajta étel, szükséges, hogy a metil-csoportok vezet utódok megváltozott minták DNS metiláció, amelyek a vártnál magasabb árak bizonyos egészségügyi problémák.
epigenetika és imprinting, miért nem mindig egyenértékűek az anya és apa génjei
mindannyiunknak 23 pár kromoszómája van a sejtjeinkben. Minden pár esetében az egyik anyától, a másik apától származik. Így minden egyes gén egy példányát örököljük minden szülőtől, és általában azt feltételezzük, hogy a gén funkciója nem függ attól, hogy melyik szülőtől származik. A lenyomott gének esetében azonban a dolgok eltérőek. E gének esetében a gén anyai vagy apai példánya aktív, míg a másik hallgat. Az emberekben és egerekben legalább 80 lenyomott gén található, amelyek közül sok részt vesz az embrió vagy a placenta növekedésében. Hogyan lehet kikapcsolni egy gén egy példányát, míg a másik példány ugyanabban a cellában be van kapcsolva? A válasz epigenetika. Valószínűleg a leginkább vizsgált nyomott gén az IGF2 (lásd fent). Az IGF2 egyik része kapcsolóként működik. Ha a DNS itt metilálódik, az IGF2 gén expresszálható. A kapcsolót csak a gén másolatában metilálják, így csak ezt a példányt fejezik ki, míg az anyai példány néma. Úgy gondolják, hogy ezt a kapcsolót az ivarsejtekben (tojás és Sperma) állítják be, így a kezdetektől fogva az anyától és az apától kapott géneket eltérően jelölik epigenetikus címkékkel, így azok nem egyenértékűek.
Feltöltési, illetve mentális zavarok
Angelmann valamint a Prader-Willi-szindrómában két különböző genetikai adottságú, különböző tünetek, mindkét által okozott veszteség egy része kromoszóma 15. Azok a gyermekek, akik öröklik ennek a hibás kromoszómának egy példányát, vagy Angelmann vagy Prader-Willi szindrómát fejlesztenek ki, annak ellenére, hogy a kromoszóma normál példánya van a másik szülőjétől. Tehát hogyan vezet ugyanaz a mutáció (a 15. kromoszóma egy részének elvesztése) e két különböző körülményhez? A válasz abban rejlik, hogy a felfedezés, hogy az adott darab kromoszóma 15 tartalmaz, gének, amelyek színű, akkor csak az apai vagy anyai példányát gén fejezik ki; amely a két szindrómák úgy tűnik, attól függ, hogy a törlést az anyai vagy paternally örökölt kromoszóma. Ha a hibás kromoszómát apától örökölték, akkor az anyai 15-ös kromoszómán kikapcsolt nyomott gének funkcionális másolata nincs, Az eredmény pedig Angelmann-szindróma, és fordítva a Prader-Willi-szindróma esetében. Ez meglehetősen különbözik a legtöbb genetikai állapottól, például a cisztás fibrózistól, ahol a fejlődésre vagy az egészségre gyakorolt hatás csak akkor látható, ha egy mutált gént vagy géneket mindkét szülőtől örökölnek.
fiúk a lányok ellen, hogyan lehet kikapcsolni egy egész kromoszómát
egy kis genetika, amelyről a legtöbben tudunk, az, ami fiúvá teszi a fiút, egy lányt pedig lánynak. Az X és Y kromoszómák. Létezésünk kezdetén mindannyian egy X kromoszómát kaptunk Anyáinktól a tojáson keresztül, míg a lányok egy másik X kromoszómát kaptak apjuktól, a spermán keresztül, a fiúk Y kromoszómát kaptak. Az Y kromoszóma egy hím embrió sejtjeiben arra irányítja, hogy fiúvá fejlődjön, míg két X és nem Y kromoszómával a női embrió lánygá alakul. Most észreveheti, hogy itt egyensúlyhiány van. Mindannyiunknak van két minden a többi kromoszóma, de a nemi kromoszómák (X és Y) a lányok két Xs, míg a fiúk csak egy X (és a Y). Míg az Y kromoszóma kevés gént tartalmaz, amelyek többnyire a “maleness” – ben vesznek részt, az X kromoszóma jó néhány olyan gént tartalmaz, amelyek fontos folyamatokban vesznek részt, mint például a színlátás, a véralvadás és az izomműködés. Annak érdekében, hogy az X kromoszóma gének “dózisát” kiegyenlítsék a hím és a női sejtek között, egy teljes X kromoszóma ki van kapcsolva a női sejtekben. Ezt X-kromoszóma inaktivációnak nevezik, és nagyon korán történik az anyaméhben. Ebben a folyamatban a sejtek véletlenszerűen kikapcsolják az apai vagy anyai X kromoszómát, így amikor egy lány baba születik, a teste olyan sejtek keveréke vagy kimérája, ahol az anyai vagy apai X-kromoszóma ki van kapcsolva. Ennek módja magában foglalja az általunk tárgyalt epigenetikus címkék típusát, és évtizedek óta ismert, hogy a női sejtek egy nagyon kompakt X kromoszómát tartalmaznak, az úgynevezett Barr-testet, amely mikroszkóp alatt látható, és ez az inaktív X kromoszóma.
a teknősbéka macska esete
valószínűleg mindannyian ismerjük a teknősbéka macskákat és foltos kabátjukat narancssárga és fekete szőrmével. Amit talán nem tudsz, az, hogy szinte minden macska ilyen típusú kabáttal nő! Ennek oka az, hogy a macska X kromoszómáján található a szőrzet színének génje. Ennek a génnek két változata létezik, az úgynevezett “O” és “o”; az egyik gyömbér szőrzetet, a másik fekete. Ugyanazon változat két példánya egy női macskában gyömbért vagy fekete szőrzetet eredményez, de mindegyik egy példánya teknősbéka hatást fejt ki. Ez az X-kromoszóma inaktivációig terjed. Ezeknek a macskáknak a bőre olyan sejtfoltokból áll, amelyekben az anyai vagy az apai X kromoszóma inaktiválódik. Ez azt eredményezi, hogy az O gén be van kapcsolva, és egyes foltokban (narancssárga szőrzet), valamint az O gén be van kapcsolva, és más foltokban (fekete szőrzet) elnémul, így a teknősbéka mintázat. Mivel a hím macskáknak csak egy X kromoszómájuk van, és nincs X-kromoszóma inaktiválás, vagy narancssárga vagy fekete az egész.
epigenetikus öröklés, az epigenetikus állapotokat egyik generációról a másikra lehet átadni?
amint azt a kerekféreg példájából láttuk, az epigenetikus hatások (ebben az esetben a meghosszabbított élettartam) néha generációról generációra továbbíthatók,bár a hatások csak néhány generációra tűnnek. Vannak olyan példák, amikor az epigenetikai hatások az emberek vagy más emlősök következő generációira terjednek át? Van némi bizonyíték arra, hogy a holland éhínség hatása az éhínség idején terhes nők unokáit érintette. Hasonlóképpen, egy 19. századi Észak-svéd népességről szóló tanulmányban, amely éhínség és sokaság ciklusán ment keresztül, úgy tűnik, hogy a rendelkezésre álló élelmiszer mennyisége befolyásolta a következő generáció egészségét és hosszú élettartamát.
az egér hajszínét epigenetikai hatás határozhatja meg
talán a transzgenerációs epigenetikai hatások legismertebb példáját az egér Agouti gén biztosítja. Ez a gén szabályozza a hajszínt, és éppen a megfelelő időben kapcsol be a szőrtüszősejtekben, hogy sárga csíkot hozzon létre az egyébként sötét szőrszálakban, ami az úgynevezett agouti kabátot eredményezi. De az Avy nevű Agouti gén egy bizonyos variánsával rendelkező egereknek olyan rétegeik vannak, amelyek bárhol megtalálhatók a sárga és a vad típusú egerek normál sötét (agouti) mintázata között. A sárga egerek is elhízott, szenved más egészségügyi problémák. Tehát úgy tűnik, hogy az Avy génnek változó hatása van(valójában az Avy változékony sárga). Hogy ez hogyan működik, évek óta zavarba hozza a genetikusokat, de ezt most epigenetikus hatásnak tekinthetjük. A sárga szőr azért fordul elő, mert az Agouti gén Avy változata hibás vezérléssel rendelkezik, és állandóan be van kapcsolva. A hibás kontroll DNS-szekvenciához azonban gyakran metilcímkéket adnak, és ez hajlamos a gént kikapcsolni, ami egyes egerekben foltos vagy sötét agouti szőrzetet eredményez. Az Avy géntartományú anyáknak született kölykök színe sárgától sötétig terjed, de az arány az anya kabátszínétől függ; a sötét (agouti) nőstények almai nagyobb valószínűséggel tartalmaznak sötét kölyköket. Ezenkívül a sötét utódok nagyobb hányada figyelhető meg, ha mind az anya, mind a nagymama sötét színű. Tehát az epigenetikusan meghatározott agouti színezés (az Avy gén metilcímkéinek számával) bizonyos mértékig átvihető az egyik generációról a másikra.
a Tojást, a sperma általában nem ‘átvitel’ epigenetikus hatások
Bár találunk olyan esetek, ahol epigenetikus hatások nyilván tart, a szülők utódai, ez általában nem az esetben pedig szinte az összes epigenetikus kapcsolók vagy jelek reset csírasejtekben (tojás, sperma), valamint a fejlesztés legkorábbi szakaszában az embrió. Valójában, ha nem ez lenne a helyzet, a megtermékenyített tojás csodálatos fejlődése teljesen kialakult lényré lehetetlen lenne.
Hogy a megtermékenyített petesejt, hogy egy teljesen kifejlett emberi, mind a (epi) genom
eddig leírt néhány konkrét esetben a epigenetikus szabályozás, de most már tudjuk, hogy epigenetics a tág értelemben vett (milyen génjei vannak kifejezve, használt, ahelyett, hogy a DNS-szekvencia a gének magukat) központi eleme, hogy egy megtermékenyített petesejt végül ad okot, hogy egy egész szervezet hogyan sejtek, mondjuk, a bőr, marad a bőr sejtek, valamint más, mint az agy sejtek, annak ellenére, hogy tartalmazó pontosan ugyanazok a gének. Röviddel a megtermékenyítés után a fejlődő emberi embrió egy sejtgolyóból áll, amelyet embrionális őssejteknek neveznek. Mindegyik sejt képes arra, hogy az embrió növekedésével a test bármely sejttípusát eredményezze (például agysejtek, bőrsejtek vagy vérsejtek). Ezzel szemben, 9 hónappal később, amikor egy csecsemő születik, a testét alkotó sejtek többsége elkötelezett amellett, hogy egy adott típusú sejt legyen, amelynek speciális funkciói vannak. Tehát ahogy a sejtek osztódnak, az embrionális őssejtek gömbje fokozatosan fejlődik a csecsemő összes sejttípusába és struktúrájába. Ahhoz, hogy ez megtörténjen, több ezer gént kell bekapcsolni vagy kikapcsolni a megfelelő időben, a megfelelő sejtekben pedig az embrió növekedésével. Például, gének, amelyek a rostos fehérje, a keratin, amely megadja a bőr erejét, csak be kell kapcsolni a bőr sejtek, nem pedig a fejlődő agy gének szükség, az agy sejtek kifejleszteni, hogy az összeköttetések vannak az agyban, de nem a bőr.
a fejlődés során a géneket ” be ” és ” ki ” kell kapcsolni. Az epigenetikus címkék segítenek ebben a
egy nagyon nagy kutatási terület ma arról szól, hogy ez a gén kikapcsolása hogyan működik, és ennek a folyamatnak nagy része az epigenetikus kémiai címkéket, különösen az acetil-és metil-hiszton címkéket használja. Annak érdekében, hogy ezek az embrionális őssejtek képesek legyenek az összes többi típusú sejt kialakulásához, epigenetikus kapcsolóik (majdnem) teljesen visszaállnak a felnőtt sejtekhez képest. Zárójelbe tettem a” majdnem ” szót, amint azt a lenyomott génekből és a transzgenerációs epigenetikai örökségből tudjuk, hogy vannak kivételek.
epigenetika, Dolly the sheep and friends
1997 februárjában egy Dolly nevű birka vált fajának leghíresebb példájává, rövid időre még TV-hírességgé is vált. Hírnevének oka az, hogy ő volt az első emlős, amelyet egy szomatikus sejt nukleáris átvitelének nevezett folyamat “teremtett”, vagyis az első ember által készített klón (az ember által készített, hogy elkülönüljön az azonos ikrektől, akik természetes klónok). A születéséhez vezető folyamat során egy nőstény juh Érett petesejtjét (egy nem fertőzött tojást), egy másik juh tőgyéből pedig egy közönséges sejtet igényelt. Először a sejtmagot (a DNS-t tartalmazó részt) eltávolították az oocitából. Ezt egy speciális mikroszkóppal végezték, mivel bár az oociták meglehetősen nagyok a többi sejthez képest, még mindig túl kicsik ahhoz, hogy szabad szemmel láthassák. Ezután a tőgysejt magját beültettük az enucleated oocyta-ba. Így Dolly-nak három “anyja” volt: az oocita donorja, a tőgysejt donora és a juhok, amelyek a fejlődő embriót hordozták. Apa nem volt benne. Bár ez a folyamat volt, és továbbra is, nagyon hatékony ez volt az első bizonyíték arra, hogy egy felnőtt emlőssejt génjei “epigenetikusan újraprogramozhatók” vissza az embrionális őssejtek állapotába, amelyek bármilyen más típusú sejtekké fejlődhetnek. Ezt követően ugyanezt a folyamatot alkalmazták más fajokra is, és orvosi felhasználásuk lehet olyan sejtek előállításában, amelyek helyreállíthatják a sérülés vagy betegség által károsított szöveteket.
összefoglaló: a epigenome a KÓDOLÁS projekt – a “Nagy Hadron Ütköztető” a Biológia
Mivel a “genom” utal, hogy a teljes DNS-szekvencia egy szervezet (három milliárd betű az emberek), a epigenome utal, hogy a teljes minta epigenetikus módosítások az összes gének, beleértve a metil-DNS kategória, metil-histone kategória, acetil histone kategória, valamint egyéb vegyi kategória, hogy nem említettük, az egyes cella típusú szervezet. Ez szinte elképzelhetetlen mennyiségű információt jelent, még az emberi genomprojekt is eltörpül. Mindazonáltal az epigenóma ismerete elengedhetetlen ahhoz, hogy teljes mértékben megválaszolhassuk a biológia néhány legnagyobb kérdését, például: hogyan alakulunk ki az azonos sejtek golyójából egy egész szervezetbe? miért öregszünk? hogyan lehet jobban megérteni az olyan betegségeket, mint a rák? Nem meglepő tehát, hogy az epigenetika és az epigenóma nagy kutatási terület. Az e területen végzett kutatások egy részét a ENCODE (Encyclopedia of DNA Elements) projekt foglalja magában, amely folyamatos vállalkozás az epigenetikus címkék mintáinak azonosítására számos különböző típusú sejtben az egész emberi genom számára (http://genome.ucsc.edu/ENCODE/). A kódolási projektet néha hasonlítják a Svájci Nagy Hadronütköztetőhöz vagy LHC-hez. Az LHC a valaha épített legnagyobb tudományos berendezés, és a vele végzett kísérletek célja a világegyetemet alkotó anyag alapvető részleteinek vizsgálata. Bár a biológusoknak nincs (vagy nincs szükségük) ilyen látványos készletre a kutatásukhoz, az emberi epigenóma bonyolultságának vizsgálatára irányuló erőfeszítéseket az LHC projekthez hasonlították annak mérete, összetettsége és a létrehozandó információk mennyisége miatt.
epigenetikai hibák
az epigenetika olyan terület, ahol tudományos ismereteink gyorsan növekednek. Az egyik dolog, amit a tudósok felfedeztek, hogy az epigenetikai hibák gyakoriak olyan betegségekben, mint a rák és az öregedő sejtek. Ennek eredményeként a tudósok olyan gyógyszereket fejlesztenek ki, amelyek hibás epigenómákat céloznak meg, és az egyik első példa a Hdac-gátlók alkalmazása, hasonlóan a méhpempőben található vegyülethez. A tanulmány különös minták örökség, mint például a genetikai szemben, a sárga/agouti Avy egér, a női teknőspáncél macska lakosság, valamint egyéb kapcsolódó jelenségek biológusok felfedeztek egy teljesen új réteg információ, hogy hazugság “tetején” a DNS-szekvencia, a gének. Ezek az új felfedezések magyarázzák ezeket a korábbi rejtélyes megfigyeléseket, de nagy potenciállal rendelkeznek az emberi betegségek új megértésére és kezelésére is.
további olvasmányok:
- Bird, Adrian. Epigenetika. Instant Expert No. 29′, New Scientist, 5th január 2013, No.2898.
- Carey, Nessa. “The Epigenetics Revolution: How Modern Biology is Rewriting Our Understanding of Genetics, Disease and öröklési”. Kiadó: Icon Books. 2012.március 1. ISBN-10: 1848313470. RRP Ár £9-99.
epigenetikai hatások és betegségek a honlapon:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply