CIMAvax-EGF: új terápiás vakcina előrehaladott tüdőrákra
jelentés
CIMAvax-EGF: új terápiás vakcina előrehaladott tüdőrákra
Gisela González1, Agustin Lage1, Tania Crombet1, Gryssel Rodríguez1, Beatriz García1, Ariadna Cuevas1, Lisel Viña1, Norkis Arteaga1, Elia neninger2
1center molekuláris immunológia, cimave. 216 corner 15, Atabey, Playa, POBox 16 040, Havanna, Kuba
2hermanos Ameijeiras HospitalSan Lázaro # 701 e / Belascoín y Marqués González, Centro Habana, Havana City, Kuba.
absztrakt
azok az eredmények, amelyek lehetővé teszik a kubai szabályozó ügynökség (CECMED) számára, hogy egészségügyi nyilvántartást adjon a CIMAvax-EGF rákos vakcinának a fejlett, nem kissejtes tüdőrák (NSCLC) esetében. Ez volt a terápiás vakcina első regisztrációja Kubában, valamint a tüdőrák elleni vakcina első regisztrációja a világon. Ezért egyedülálló terápiás vakcinát kínálnak a tüdőrákos betegeknek, ami növeli a túlélést és életminőségüket. Ebből a célból jelentős preklinikai, klinikai, szabályozási, produktív és tárgyalási kihívásokkal kellett szembenézni. Az ezeken a területeken elért eredmények eredményeként 18 tudományos cikk jelent meg nagy hatású folyóiratokban és 4 találmányi tárgyban, amelyek számos szabadalmat generáltak Kubában és más országokban. A preklinikai körülmények között immunogenitást, biztonságosságot és daganatellenes hatást mutattak ki különböző állatfajokban. A klinikai tapasztalat 1995-ben kezdődött. Eddig öt I-II fázisú klinikai vizsgálat zárult le Kubában, két II. fázis is lezárult, az egyik Kubában, a másik Kanadában és az Egyesült Királyságban, és jelenleg folyamatban van egy optimalizált ütemtervű II-III.fázisú vizsgálat, valamint egy III. fázisú vizsgálat Kubában. A szabályozási területen egy gyorsított regisztrációs stratégiát dolgoztak ki és hajtottak végre. Ehhez az egyedi termék kifejlesztéséhez új szabályozási koncepciókra volt szükség. Egy skálázható, reprodukálható és ellenőrzött termelési eljárást hajtottak végre, valamint egy olyan minőségbiztosítási rendszert, amely teljes körű GMP-megfelelést biztosított. A termékfejlesztési források egy új tárgyalási stratégia megvalósításából származtak: az immateriális javak tárgyalása.
kulcsszavak: Cancer vaccine, NSCLC, Fast-Track Registration, CIMAvax-EGF, Phase II-III Clinical Trial
bevezetés
az epidermális növekedési faktor receptor (EGFR) és ligandumai közötti kapcsolat a rák kialakulásával jól ismert. Az epidermoid eredetű daganatokban az EGFR túlzott expressziója a rossz prognózisokra és a műtét utáni korai relapszusokra vonatkozik. Ezért vált ez a rendszer fontos célpontjává a daganatellenes terápiáknak.
A sejtproliferációs mechanizmusok az EGF EGFR-hez való kötődésével kezdődnek. Terápiás megközelítésünk egy EGF-formulával rendelkező vakcinából áll, amely immunogénné teszi, és humorális immunválaszt idéz elő. Az autológ EGF-hez kötődő specifikus anti-EGF antitestek termelése megakadályozza, hogy kötődjön az EGFR-hez, ezáltal kiváltva az ebből a kölcsönhatásból származó sejtproliferációs mechanizmusokat (1-4).
itt jelentjük a vakcina Kubában történő regisztrációjának eredményeit (CIMAvax-EGF). Ez egy olyan globális stratégia része volt, amely új klinikai, szabályozási, technológiai és üzleti hozzájárulásokat tartalmaz, és amelyet világszerte 18 nemzetközi tudományos cikk és szellemi tulajdon támogat. Olyan újításokat is leírunk különböző területeken, amelyek lehetővé tették a CIMAvax-EGF regisztrációját Kubában és Peruban.
eredmények és megbeszélések
az EGF-vel végzett vakcinázás biztonságos, immunogén és jó életminőséggel növeli a túlélést előrehaladott stádiumú betegeknél tüdőrák
a CIMAvax-EGF-vel kapcsolatos klinikai tapasztalatok a nem kissejtes tüdőrák (NSCLC) terápiájában előrehaladott stádiumban, 1995-ben kezdődtek. Eddig öt I-II. fázisú klinikai vizsgálat zárult le Kubában; 2 randomizált II.fázisú klinikai vizsgálat zárult le, az egyik Kubában, a másik Kanadában és az Egyesült Királyságban, és folyamatban van egy III. fázisú vizsgálat Kubában. Több mint 800 előrehaladott daganatos beteget kezeltek CIMAvax–EGF-rel, ezzel bizonyítva, hogy biztonságos, immunogén és jó életminőség mellett képes növelni a túlélést.
az I-II. fázisú vizsgálatok fő célja az volt, hogy eldöntsék a vakcina legjobb formuláját (hordozófehérje és adjuváns), az adagot és a terápiás ütemtervet. Ezek az eredmények a p64k fehérje hordozófehérjeként, valamint az ISA51 MONTANID adjuvánsként való előnyeit igazolták. A dózis növelésének fokozott immunogenitását is igazolták (5-7).
Az elemzés az összegyűjtött adatokat a fázis i-II vizsgálatokban jelentős növekedést mutatott a túlélés azok a betegek jobban antitestválaszt vagy jó antitest reagálók (GAR), valamint a betegek kifejezettebb csökken a sera EGAA-koncentráció () eredő oltás. Az összes beoltott beteg túlélésének szignifikáns növekedését is igazolták, összehasonlítva egy egyidejű, korábbi kontrollal (7).
fázis II klinikai vizsgálatot végeztek 80 betegen, akiket a CIMAvax-EGF és a best supportive care (BSC) (40 beteg) vagy a BSc monoterápiára (40 beteg) randomizáltak az első vonalbeli kemoterápia befejezését követően. A korábbi megállapításokat a tárgyalás során megerősítették. A beoltott betegek körülbelül 50% – a gar volt, és szignifikánsan többet élt túl, mint azok a betegek, akik nem érték el a GAR-besorolást (akiket gyenge antitest-válaszadóknak minősítettek, PAR). Hasonlóképpen, azoknál a betegeknél, akiknél a legnagyobb a csökkenés, szignifikánsan több maradt fenn, mint azoknál a betegeknél, akik nem mutatták ezt a csökkenést (1.táblázat). Jelentős inverz korrelációt figyeltek meg az anti-EGF antitest titerek között , és amelyek vakcinázott betegeknél fordultak elő, de nem a kontrollokban, így bizonyítva, hogy a vakcinázás okozta (1.ábra). 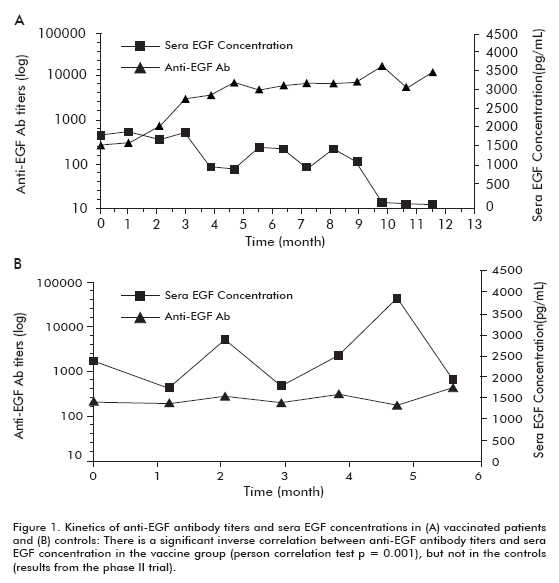
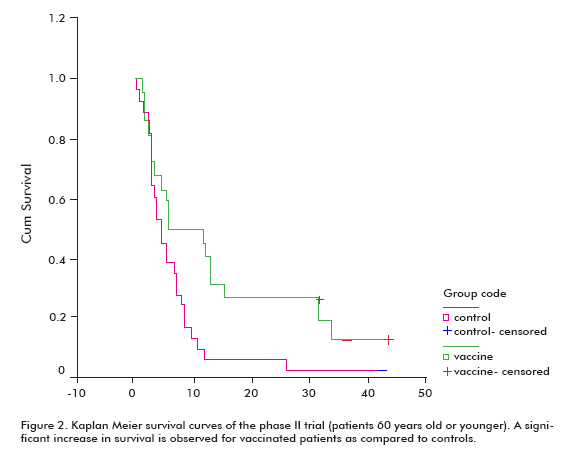
volt egy nagyobb trend a túlélés minden beoltott betegek (18.53 ± 11.47; átlag ± medián), szemben a nem vakcinázott ellenőrzések (7.55 ± 5.33), amely szignifikáns volt a 60 éves vagy annál fiatalabb betegek csoportjában (Log rang teszt; p < 0, 05) (2.ábra) (8).
amint azt egy in vitro versenyvizsgálat is bizonyítja, a vakcinázott betegek szérumai gátolták az EGF EGFR-hez való kötődését. Ez a kötődési gátlás arányos volt az antitest titerekkel és a túléléssel. Ezenkívül a vakcinázott betegek szérumai gátolták az EGFR foszforilációját az anti-EGF antitest titerekkel arányosan.
az EGF/EGFR kötőhely (az EGF molekula B hurokja) preferenciális felismerését vizsgálták. Azok a betegek, akiknek széruma előnyben részesíti a B hurok felismerését, szignifikánsan többet túléltek, mint azok a betegek, akik nem ismerték fel ezt az epitópot (9).
a közelmúltban Kubában (I-II. Tervezése során figyelembe vették a korábbi vizsgálatokban az immunogenitást növelő összes elemet, amely magában foglalta: A Montanide ISA51 adjuvánsként, megnövekedett dózisok, négy injekció beadási hely és két vakcina adag beadása az elsővonalbeli kemoterápia előtt, majd vakcinázás. A vizsgálat eredményei az immunogenitás jelentős növekedését mutatták, a GAR 95% – A elérte a korábbi maximális antitest titer tízszeresét. Az összes beoltott pa-tient szignifikánsan jobban fennmaradt, mint a II.fázisú vizsgálat (10) kontrolljai.
a betegek szérumának az EGF/EGFR-kötődés és az EGFR-foszforiláció gátlására irányuló megnövekedett kapacitását is megállapították. A hetedik hónapban, a kemoterápia befejezése után, az antitestválasz az EGF molekula B hurok felé tolódott, ami az immunválasz minőségének javulását jelezheti. A vizsgálat eredményei azt mutatták, hogy a CIMAvax-EGF-re adott válasz javulása a dózis és a terápiás ütemterv manipulálásával érhető el (10).
ezeknek a vizsgálatoknak az eredményeit egy jelenleg Kubában folyamatban lévő III. fázisú vizsgálatban validálják.
Tervezése, végrehajtása, szabályozási stratégia a vakcina regisztráció elérhetővé az előrehaladott nem-kissejtes tüdőrákos betegek
CIMAvax-EGAA-egy terápiás vakcina a tüdőrák, amely egyedülálló a világon. Globális stratégiát dolgoztak ki és valósítottak meg; szabályozási követelmények vezérelték, a gyorsított regisztrációhoz Kubában. A szponzor (CIM) és a kubai szabályozó ügynökség (CECMED) közötti szoros kapcsolat célja az volt, hogy meghatározza a termék beszerzésére vonatkozó követelményeket és annak gyors alkalmazását előrehaladott rákbetegek javára, más terápiás alternatíva nélkül. Ez a stratégia magában foglalta a minőségbiztosítási rendszer kialakítását, a minőségellenőrzést és a specifikációkat, valamint a termékfejlesztés különböző lépéseit lefedő GMP-követelményeket. Ez a globális stratégia más hasonló termékek fejlesztésében is használható.
a felhalmozott szabályozási tapasztalat és dokumentáció a különböző országokban végzett klinikai vizsgálatok jóváhagyásához vezetett. Az összes információt tartalmazó dosszié lehetővé tette a CIMAvax-EGF regisztrálását Kubában és Peruban. Ezért kijelenthetjük, hogy van egy meghatározott stratégiánk a kábítószer-regisztrációra a különböző országokban.
a GMP gyártási folyamata, amely skálázható, konzisztens és a specifikációknak megfelelő terméket állít elő
a CIMAvax-EGF gyártási folyamatának megtervezésének első kihívása az volt, hogy immunogén EGF-készítménnyel rendelkezzen. A humán rekombináns EGF-nek a rekombináns membránfehérjéhez, a p64k-hoz (Neisseria meningitidis-ből) történő kémiai konjugációjával nyerték. A konjugátumot megfelelő adjuvánssal együtt injektálják (jelenleg a Montanide isa 51 A Seppic-ből, Franciaország).
kezdetben laboratóriumi léptékű eljárást terveztek. A GMP-irányelveknek megfelelően később egy méretarányos (és méretezhető) egészségügyi és reprodukálható eljárást terveztek és hajtottak végre. In vitro és in vivo analitikai vizsgálatokat is terveztek és hajtottak végre a nyersanyagok, valamint a köztes és végtermékek minőségének értékelésére.
az összes módosítást a jelenlegi szabályozási stratégia értékelte és támogatta. Az egyenértékűségi vizsgálat eredményei, a két termék összehasonlítása érdekében, megkapta a CECMED jóváhagyását a méretezett eljárásalkalmazásról, valamint az ebben a folyamatban kapott termék klinikai felhasználásra történő jóváhagyását. A gyártási folyamat méretezése és optimalizálása egy publikációnak (11) és egy új találmánynak adott helyet, amelynek szabadalmait később különböző országokban mutatták be.
a Tárgyalás a megfoghatatlan dolgok nyújtják számunkra a források projekt-fejlesztés, valamint tanulási tapasztalat, a közös munka szabályozó hatóságok a különböző országok
Ez a Projekt tárgyalásokat folytatott külföldi társaik alapján új fogalmát, a “tárgyalás a megfoghatatlan dolgok”, támogatott, elsősorban a szellemi tulajdon a termék esetében, amely fejlesztés alatt áll. Ez a tárgyalási stratégia a projekt más országokkal való közös fejlesztésének engedélyezését jelentette, ami azt jelenti, hogy a külföldi partnerek fedezték a területükön végzett szabályozási intézkedések és klinikai vizsgálatok költségeit. E tárgyalások eredményeként Kuba kifizetéseket kapott a mérföldkövekért. Ez a tárgyalási mód lehetővé tette számunkra, hogy folyamatosan cseréljünk szakemberekkel itt és külföldön, ezáltal növelve tapasztalatainkat. Pozitív eredményeink ezzel a tárgyalási modalitással más, hazánkban folyamatban lévő termékekre is alkalmazhatók.
A vizsgálat relevanciája
A CIMAvax-EGF az első terápiás vakcina a Kubában regisztrált rákkezelésre, és az első a világon a tüdőrák kezelésére. A tüdőrák megoldatlan egészségügyi probléma, évente több mint 1, 3 millió esetet diagnosztizálnak, és ugyanannyi halálesetet az egész világon. Kubában ez a fő halálok a rák miatt mindkét nemben, évente több mint 4000 elhunyt előfordulásával. A fejlett stádiumokban diagnosztizált betegek választott terápiája az első vonalbeli kemoterápia, amely sugárterápiával egyidejűleg adható be. Ez egy palliatív, nem gyógyító kezelés, a kemoterápiára adott teljes válasz nagyon ritka, és objektív (teljes vagy részleges) válasz a betegek mindössze 25% – ánál fordul elő.
A CIMAvax-EGF alternatív kezelést kínál azoknak a betegeknek, akik már részesültek elsővonalbeli kemoterápiában. A kemoterápia és/vagy sugárterápiás kezelések súlyos mellékhatásai jól ismertek, és súlyosan rontják az életminőséget. Ehelyett a CIMAvax-EGF vakcinázás csak enyhe vagy közepesen súlyos, nem pedig súlyos mellékhatásokat eredményez, amelyeket a hagyományos szupportív kezeléssel lehet megoldani, miközben javítja az előrehaladott tüdőrákos betegek túlélését, és jó életminőséget kínál.
eddig több mint 800 Kubánt kezeltek CIMAvax-EGF-vel az ország több mint 20 kórházában. A CIMAvax-EGF regisztrálása lehetővé teszi annak kiterjesztését az ország összes olyan betegére, akiknél előrehaladott tüdőrákot diagnosztizáltak; így Kubát a világ első országává teszi egy nemzeti programmal, amely ezt a terápiás alternatívát használja.
ami a gazdasági előnyöket illeti, a projekt tárgyalásai során 6, 346 millió USD-t kaptunk. A projekt tárgyalási stratégiája más országokkal való közös fejlesztése, ami azt jelenti, hogy a külföldi partner fedezi a saját országukban végzett klinikai vizsgálatok költségeit, megfizethetővé téve azt. Ezek a kísérletek több millió USD befektetést igényelnek, és ez csak akkor lehetséges, ha külföldi társaik támogatják. Ugyanakkor ez a stratégia több klinikai adatot kínál Kubának, anélkül, hogy a vizsgálatok elvégzésének költségei itt lennének. Eddig Kanadában, az Egyesült Királyságban és Malajziában végeztek klinikai vizsgálatokat. A közeljövőben klinikai vizsgálatok kezdődnek Kínában és Európában.
Ezen engedélyezési stratégia részeként a külföldi partnerek felelősek a termékek nyilvántartásba vételéért azokban a régiókban, ahol kereskedelmi jogaik vannak. A regisztrációs és marketing folyamatok során Kuba a mérföldkövekért, majd később az értékesítési jogdíjakért kap kifizetéseket.
a rákos vakcinák világpiacát milliárd dollár nagyságrendűnek tekintik. Az a tény, hogy Kuba egyedülálló termékkel rendelkezik a fejlett tüdőrák kezelésére, olyan exportpotenciált nyújthat nekünk, amely finanszírozhatja a termék használatát nemzeti egészségügyi rendszerünkben.
következtetések
A CIMAvax-EGF-vel végzett vakcinázás biztonságos, immunogén, és a túlélés növekedéséhez vezet, jó életminőség mellett előrehaladott stádiumú tüdődaganatokban szenvedő betegeknél. Az oltóanyag nyilvántartásba vételére vonatkozó szabályozási stratégia kialakítása és végrehajtása lehetővé tette, hogy a Kubában előrehaladott, nem kissejtes tüdőrákos betegek minden esetére rendelkezésre álljon
. Ez a pozitív tapasztalat más folyamatban lévő hasonló termékekre is alkalmazható. Kifejlesztettek egy gyártási eljárást, amely skálázható, következetes és reprodukálható volt, és megfelelt a GMP irányelveinek, hogy olyan terméket állítsanak elő, amely megfelel a specifikációknak. A tapasztalat tárgyalási a megfoghatatlan dolgok, nagyon pozitív, de biztosított minket alapok a fejlesztési projekt, miközben támogatja a tanulási tapasztalat származó közös munka, a szabályozó hatóságok, a különböző országokban.
elismerések
a szerzők köszönetet akarnak mondani a molekuláris immunológia Központjának következő szakembereinek a munkájukért: Rolando Pérez, Loany Calvo, Suhamy, Belinda Sánchez, Irene Beausoleil, Ernesto Chico, Airama Alvisa, Ileana Carroman, Sergio Tasting, Ana Veloso, Reinaldo Crow, Yanelda Lopez, Yosniel Hernández, Antonio Vallin, Alejandro Portillo, Liuva Wood, Guido Ferrer, Diana Borges, Niuvis Pérez, Tamara García, Idaine Basin, Mayra Santaelena, Joaquin Solozabal, Aida Rodriguez, Maria Elena Garcia, Addis Torres, Eric Chong, Carmen Roll, Mauritius Catala, Soraida Acosta, Barbara Wilkinson, Olga Torres, Normando Iznaga mind a molekuláris immunológia központjából, valamint Danielnek González, Lourdes B Costa, Galina M Moya, Rolando Páez, Gerardo Guillén , Vivian Pujol, Dinorah Torres a géntechnológiai és Biotechnológiai központból.
1. González G, Montero E, León K, Cohen IR, Lage A. az epidermális növekedési faktor Autoimmunizációja, az im-munológiai homunculus egyik összetevője. Autoimmunn Rev 2002; 1: 89-95.
2. Lage A, Crombet T, González G. célzás epidermális növekedési faktor receptor jelző: korai eredmények és jövőbeli trendek onkológiai. Ann Med 2003;5 (35): 327-36.
3. González G és Lage A. rák elleni vakcinák az immunhiányos hormonokra: Az EGF vakcina megközelítése: a rákkutatás vezető témái, 11. fejezet, Ed Nova Publishers, 2007.
4. González G és Lage A. rák elleni vakcinák hormon / növekedési faktor immunhiány esetén: a rákkezelés megvalósítható megközelítése. Curr Rák Gyógyszer Célok 2007; 7: 229-41.
5. González G., Crombet T., Torres F., Catala M., Alfonso L., Osorio M., et al. Epidermális növekedési faktor alapú rák elleni vakcina nem kissejtes tüdőrák kezelésére. Ann Oncol 2003;14:461-6.
6. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. NSCLC betegek kezelése EGF – alapú rákos vakcinával. Jelentés az I. fázisú tárgyalásról. Rák Biol Ther 2006; 5 (2): 136-41.
7. González G, Crombet T, Neninger E, Viada C, Lage A. epidermális növekedési faktorral (EGF) végzett terápiás vakcinázás előrehaladott tüdőrákban: három klinikai vizsgálat összesített adatainak elemzése. Hum 2007;3 (1): 8-13.
8. Neninger E, de la Torre A, Osorio M, Catald M, Bravo I, Mendoza M, et al. Fázis II randomizált, kontrollos vizsgálat epidermális növekedési faktor vakcinával előrehaladott, nem kissejtes tüdőrákban. J Clin Oncol 2008;26:1452-8.
9. García B, Neninger E, de la Torre A, Leonard I, Martínez R, Viada C, et al. Az epidermális növekedési faktor/epidermális növekedési faktor Receptor antipermal növekedési faktor antitestekkel való kötődésének hatékony gátlása az epidermális növekedési faktor vakcinával kezelt, előrehaladott, nem kissejtes tüdőrákos betegek jobb túléléséhez kapcsolódik. Clin Cancer Res 2008; 14 (3): 840-6.
10. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda S, Leonard I, et al. EGF – alapú rák elleni vakcina kombinálása kemoterápiával előrehaladott, nem kissejtes tüdőrákban. J. 2009;32: 92-9.
11. A, A, A, A, A, A, A, A, A, a, A, et al. Gyártási folyamat fejlesztése epidermális növekedési faktor alapú rák vakcina. Bio-pharm Int, Vaccines Suppl, Oct 2008.
Leave a Reply