Biológia I
tanulási eredmények
- azonosítsa az egyszerű kémiai reakciók összetevőit
minden elem a legstabilabb, ha legkülső héját az oktettszabály szerint elektronokkal töltik meg. Ez azért van, mert energetikailag kedvező, hogy az atomok ebben a konfigurációban legyenek, és stabilvá teszi őket. Mivel azonban nem minden elem elég, elektronok, hogy töltse ki a legkülső héját, atomok formában kémiai kötések más atomok ezáltal megszerzése az elektronok van szükségük, hogy elérjék ezt a stabil elektron konfiguráció. Amikor két vagy több atom kémiailag kapcsolódik egymáshoz, a kapott kémiai szerkezet egy molekula. Az ismert vízmolekula, a H2O két hidrogénatomból és egy oxigénatomból áll; ezek összekapcsolódnak, hogy vizet képezzenek, amint azt az 1.ábra szemlélteti. Az atomok molekulákat képezhetnek azáltal, hogy adományozzák, elfogadó, vagy megosztják az elektronokat a külső héjak kitöltésére.
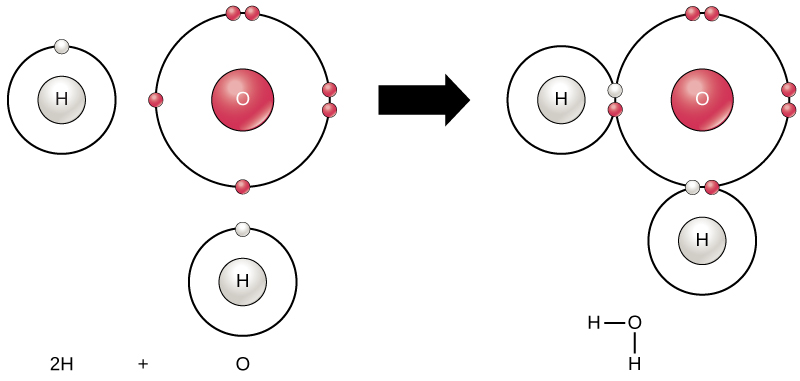
1.ábra. Két vagy több atom kötődhet egymáshoz, hogy molekulát képezzen. Amikor két hidrogén és egy oxigén kovalens kötéseken keresztül osztja meg az elektronokat, vízmolekula keletkezik.
kémiai reakciók akkor fordulnak elő, amikor két vagy több atom összekapcsol, hogy molekulákat képezzenek, vagy ha a kötött atomok széttörnek. A kémiai reakció kezdetén használt anyagokat reaktánsoknak nevezik (általában egy kémiai egyenlet bal oldalán találhatók), a reakció végén található anyagokat pedig termékeknek nevezik (általában egy kémiai egyenlet jobb oldalán találhatók). A reagensek és a termékek között általában egy nyíl húzódik, amely jelzi a kémiai reakció irányát; ez az irány nem mindig “egyirányú utca”.”A fenti vízmolekula létrehozásához a kémiai egyenlet a következő lenne:
2h + O → H2O
egy egyszerű kémiai reakció példája a hidrogén-peroxid molekulák lebontása, amelyek mindegyike két oxigénatomhoz (H2O2) kötött hidrogénatomból áll. A reaktáns hidrogén-peroxidot vízbe bontják, amely egy két hidrogénatomhoz (H2O) kötött oxigénatomot és két oxigénatomból (O2) álló oxigént tartalmaz. Az alábbi egyenletben a reakció két hidrogén-peroxid molekulát és két vízmolekulát tartalmaz. Ez egy példa egy kiegyensúlyozott kémiai egyenletre, ahol az egyes elemek atomjainak száma megegyezik az egyenlet mindkét oldalán. Az anyagmegőrzési törvény szerint a kémiai reakció előtti és utáni atomok számának egyenlőnek kell lennie, oly módon, hogy normál körülmények között egyetlen atomot sem hoznak létre vagy semmisítenek meg.
2H2O2 (hidrogén-peroxid) → 2H2O(víz) + O2 (oxigén)
bár mind a reagensek termékek a reakció molekulák (minden atom továbbra is kötve, hogy legalább egy másik atom), ez a reakció csak a hidrogén-peroxid meg a víz képviselője alosztálya molekulák ismert vegyületek: tartalmaznak atomok több, mint egy típusú elem. A molekuláris oxigén viszont, amint azt a 2. ábra mutatja, két kétszeresen összekapcsolt oxigénatomból áll, és nem vegyületként, hanem elemként van besorolva.
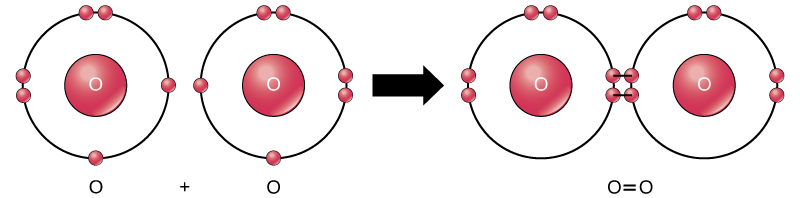
2.ábra. Az O2 molekulában lévő oxigénatomokat kettős kötés köti össze.
néhány kémiai reakció, például a fent látható, egy irányban folytatódhat, amíg a reagensek mindegyike fel nem használt. Az ezeket a reakciókat leíró egyenletek egyirányú nyilat tartalmaznak, és visszafordíthatatlanok. A reverzibilis reakciók azok, amelyek mindkét irányba haladhatnak. A megfordítható reakciók, fehérjék fordult a termékek, de ha a koncentráció termék túllép egy bizonyos küszöbértéket (jellemző az adott reakció), ezek a termékek konvertálja vissza a fehérjék; ezen a ponton, a megnevezések a termékek fehérjék fordított. Ez oda-vissza addig folytatódik, amíg meg nem történik egy bizonyos relatív egyensúly a reaktánsok és a termékek között—az egyensúlynak nevezett állapot. A reverzibilis reakciók ezen helyzeteit gyakran egy kémiai egyenlet jelöli, amelynek kétfejű nyílja mind a reagensek, mind a termékek felé mutat.
például az emberi vérben a felesleges hidrogénionok (H+) kötődnek a hidrogén-karbonát ionokhoz (HCO3–), amelyek egyensúlyi állapotot képeznek szénsavval (H2CO3). Ha szénsavat adnának ehhez a rendszerhez, annak egy részét hidrogén-karbonátná és hidrogénionokká alakítanák át.
HCO3– + H+ ↔ H2CO3
biológiai reakciókban azonban az egyensúly ritkán alakul ki, mivel a reaktánsok vagy termékek vagy mindkettő koncentrációja folyamatosan változik, gyakran az egyik reakció terméke egy másik reagens. Ahhoz, hogy visszatérjen a vérben lévő felesleges hidrogénionok példájához, a szénsav képződése lesz a reakció fő iránya. A szénsav azonban szén-dioxid-gázként is elhagyhatja a testet (kilégzés útján), ahelyett, hogy bikarbonát-ionokká alakulna vissza, ezáltal jobbra vezetve a reakciót a tömeghatalmi törvény néven ismert kémiai törvény. Ezek a reakciók fontosak a vérünk homeosztázisának fenntartásához.
HCO3– + H+ ↔ H2CO3 ↔ CO2 + H2O
összefoglalva: Kémiai reakciók és molekulák
a külső elektronhéj azt diktálja, hogy egy adott atom milyen könnyen és milyen típusú kémiai kötéseket képez. A vegyületek képződését gyakran vizuálisan vázolják kémiai egyenletekben, amelyek azt mutatják, hogy a kémiai reakciókban részt vevő reagensek termékeket képeznek.
próbálja ki
javítsa ezt az oldalt
Leave a Reply