A metasztatikus Kasztrátum-rezisztens prosztatarák első vonalbeli kezelése
2019-ben a prosztatarák (PCA) az USA-ban a férfiak körében közel 5 új rákos diagnózisát jelenti.1 az elmúlt néhány évben a teljes prosztatarák (PCA) előfordulási aránya évente körülbelül 7% – kal csökkent.1 az incidencia hirtelen csökkenését általában a prosztata-specifikus antigén (PSA) 2008-tól 2013-ig végzett csökkent vizsgálatának tulajdonították. A PSA-szűrés csökkent használatát az Egyesült Államok (USA) Preventive Services Task Force ajánlásai okozták a rutin PSA-szűrés ellen. Ez kifejezetten a 75 éves vagy annál idősebb férfiak esetében D-fokozatú ajánlás volt, amelyet 2008-ban jelentettek be, majd 2011-ben minden férfira kiterjesztették, a túldiagnózis és az előkezelés növekvő aggályai miatt.2 bár a PSA-vizsgálatok prevalenciája 2013-tól 2015-ig megállt és stabilizálódott, a szűrővizsgálatok hatása az előrehaladott betegség előfordulására még nem tisztázott. Az Egyesült Államok lakosságának 89%-át lefedő nagy Rákregiszter elemzése arról számolt be, hogy a PCa incidenciájának általános csökkenése valójában elfedi a távoli stádiumú diagnózisok növekedését 2010-től az életkor és a faj között.4
az alkalmazott kezeléstől függetlenül a lokalizált PCa-ban szenvedő betegek körülbelül 20-30% – a áttétes betegséggé fejlődik, amelyet általában hormonterápiával kezelnek.5 ezt sebészeti kasztrálással (kétoldalú orchiectomia) vagy orvosi kasztrálással lehet adni androgén deprivációs terápia (ADT) alkalmazásával. Mindkét módszer a szérum tesztoszteron kasztrált szintjét éri el, amelyet a metasztatikus hormonérzékeny PCA (mHSPC) kezelésének standardjának tekintnek. Az mHSPC-nek azonban a metasztatikus kasztrátum-rezisztens prosztatarákra (mCRPC) kell haladnia.6 a kasztrátum-rezisztens prosztatarák (CRPC) állapotát a betegség progressziójának definiálják, annak ellenére, hogy elérték a kasztrált tesztoszteron szintet (szérum tesztoszteron < 50 ng/dL vagy 1.7 nmol / L), és a szérum PSA-szint folyamatos emelkedését, a már meglévő betegség progresszióját és/vagy új metasztázisok megjelenését jelentheti.7 a CRPC átlagos túlélése körülbelül három év8, és az életminőség jelentős romlásával jár.9 az mHSPC-ről az mCRPC-re való áttérés pontos mechanizmusa még mindig nem tisztázott. Ismeretes azonban, hogy az androgének kasztrált szintje ellenére az androgénreceptor (AR) aktív marad, és továbbra is a PCA progresszióját hajtja végre a CRPC-ben.10 Ez új szerek kifejlesztéséhez vezetett, amelyek célja az androgén termelés további csökkentése vagy az AR funkció blokkolása. Vannak azonban más biológiai utak is, amelyek az androgén jelátviteltől függetlenül működnek, és CRPC-t is eredményeznek.
Több jelentős elmozdulások történtek a kezelési lehetőségek a mHSPC teret eredményez, jelentős túlélési előny (lásd “A gyorsan változó irányítási stratégia az áttétes Hormon-Érzékeny Prosztata Rák” link), beleértve a bevezetés a kemoterápia a CHAARTED study11, majd ESZEVESZETT tárgyalás,12 a kiegészítéssel, abiraterone-acetát prednizolon a SZÉLESSÉG study13, majd ESZEVESZETT tárgyalás,14 a kiegészítéssel, enzalutamide a BOLTÍVEK trial15 a ENZAMET tanulmány,16, végül a kiegészítéssel, apalutamide, orális szteroid antiandrogén, amely, mint az enzalutamid közvetlenül kötődik az AR ligand-kötő doménjéhez, és megakadályozza az AR transzlokációt, a DNS-kötődést és az AR-mediált transzkripciót.17 a TITAN-vizsgálatban az apalutamiddal kezelt mHSPC-s betegeknél a teljes túlélés (os) előnyei voltak.18 Apalutamide azt is kimutatta, haszon, mint a placebo a nem áttétes CRPC (nmCRP) beállítást a SPÁRTAI fázis 3, placebo-kontrollált vizsgálatban,19 hasonló a haszon által mutatott enzalutamide kezelt nonmetastatic herélni-rezisztens prosztata rák (nmCRPC) a betegek, a PROSPER trial20 (lásd: “A regény kezelések a nem áttétes herélni-rezisztens prosztatarák” link). Az mHSPC-és nmCRPC-beállítás ezen kezelési eredményei felvetették azt a kérdést, hogy mely kezelési lehetőségeket kell kínálni az mCRPC-beállítás alatt álló betegeknek.21
a férfiak CRPC-vel történő kezelése drámaian megváltozott az elmúlt 15 évben. 2004 előtt, amikor a betegek nem kaptak elsődleges ADT-t, a kezeléseket kizárólag palliáció kezelésére alkalmazták. A mérföldkő vizsgálatok Tannock et al.22 és Petrylak et al.2004-ben 23 volt az első, aki docetaxel kemoterápiát vezetett be mCRPC-ben szenvedő betegeknél, akikről kimutatták, hogy javítják a túlélésüket. Mivel azonban a docetaxelt az FDA jóváhagyta, öt további, túlélési előnyt mutató jótékony szert engedélyeztek az FDA által randomizált klinikai vizsgálatok alapján (1.táblázat). Ide tartoznak az enzalutamid és az abirateron, amelyek kifejezetten befolyásolják az androgén tengelyt, az immunrendszert stimuláló sipuleucel-T;24 kabazitaxel, amely egy másik kemoterápiás szer;25 és radium-223, radionuklid terápia.26 egyéb kezelések mCRPC kimutatták, hogy javítja az eredményeket, de még nem hagyta jóvá az FDA, majd megvitatják egy másik felülvizsgálat. Mivel a jelentős növekedése több FDA által jóváhagyott terápiás szerek a betegek CRPC, orvosok bizonytalanok a nagyszámú kezelési lehetőségek sokasága lehetséges szekvenciák ezeknek a szereknek, hogy a klinikai döntéshozatal mCRPC lényegesen összetettebb.
1. táblázat. Ügynökök, amelyek forgalomba hozatalát a metasztatikus herélni-rezisztens prosztatarák az usa-ban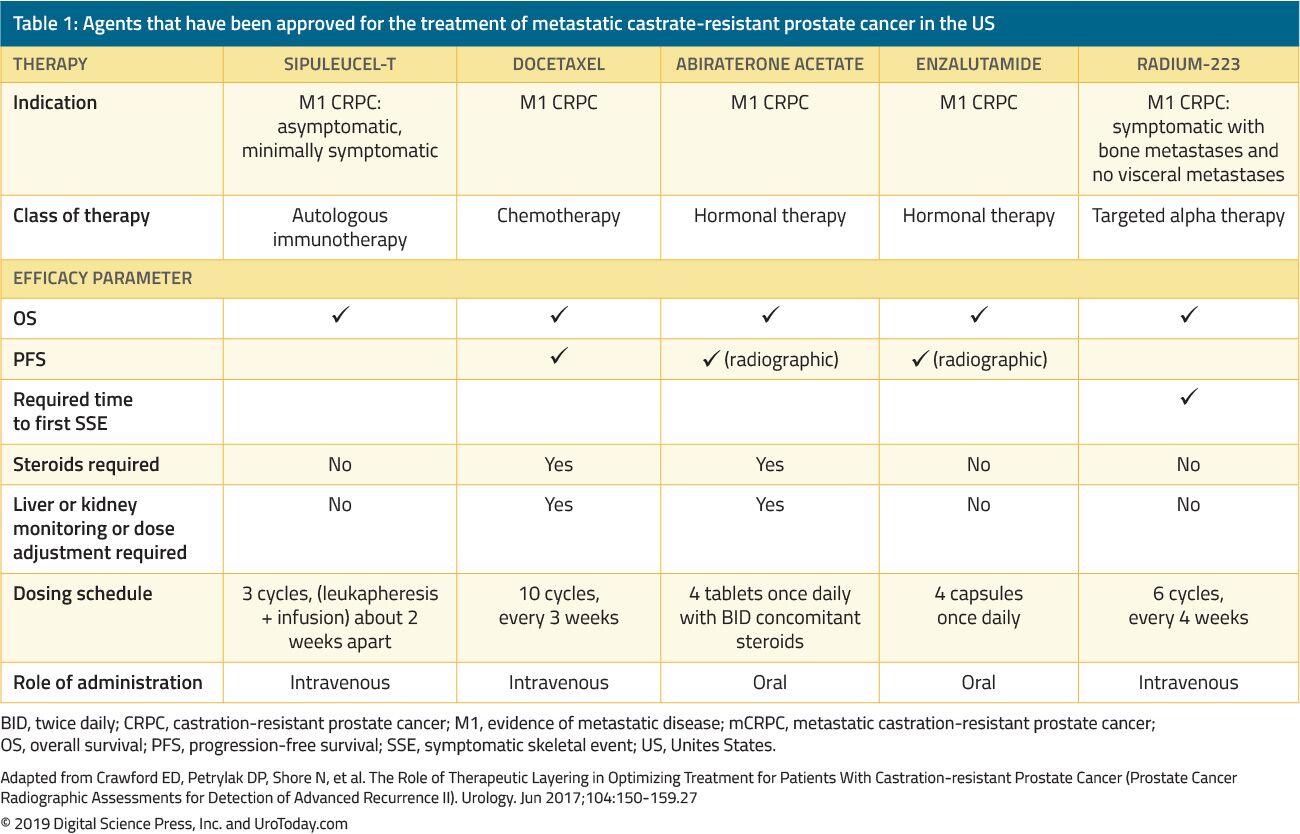
mCRPC általában legyengítő betegség, a betegek nagy valószínűséggel részesülnek irányítási stratégia formalizált egy multidiszciplináris csapat, amely urologists, orvosi onkológusok, sugárzás onkológusok, nővérek, pszichológusok, szociális munkások.28 a további szisztémás kezelés mérlegelésekor feltétlenül meg kell beszélni a palliációs kezelési lehetőségeket, beleértve a fájdalom, székrekedés, anorexia, hányinger, depresszió és fáradtság kezelését.
egy másik fontos szempont, amelyet figyelembe kell venni a megfelelő kezelési szekvencia meghatározásakor ebben a betegségtérben, a kapcsolódó költség. A docetaxel előtt vagy után további kezelési vonalakat tartalmazó modellek alkalmazásával az mCRPC-kezelés átlagos költsége 28, 1 hónap alatt körülbelül 48 000 dollár volt betegenként.29 Ez a költség meglehetősen magas annak a ténynek köszönhetően, hogy a betegek több terápiás vonalat kaphatnak, és betegségük során folyamatos orvosi szolgáltatásokat vehetnek igénybe.30
csak két vizsgálat igazolta, hogy az LHRH – analógokkal kezelt betegeknél marginális túlélési előny áll fenn a második és harmadik vonalbeli terápiák hozzáadása helyett.31 32 tanulmány kimutatta, hogy a CRPC nem ellenáll az ADT-nek, hanem túlérzékeny rá.10 a kezelés által közvetített szelekciós nyomás az ADT során az AR erősödését eredményezi, és biztosítja, hogy a helyzet ne fokozódjon, az ADT-t továbbra is az mCRPC beállításban kell alkalmazni. A kezelés által közvetített szelekciós nyomás a tumor teljes élettartama alatt is folytatódik, fokozva a helyes szekvencia terápiák szükségességét. Mivel azonban a prospektív adatok hiányoznak, a kasztráció folytatásának potenciális előnye még mindig meghaladja a kezelés minimális kockázatát. Ezenkívül az összes később jóváhagyott kezelést folyamatos ADT-vel rendelkező férfiakban tanulmányozták, hozzáadva egy másik okot, hogy miért kell folytatni.
mielőtt belemerülne a tényleges rendelkezésre álló kezelési lehetőségekbe, fontos felismerni, hogy még mindig nem világos, mikor kell elkezdeni a terápiát teljesen tünetmentes mcrpc betegeknél. Még nem ismert, hogy a korábbi kezelés jobb-e, vagy meg kell várnunk, amíg a beteg tüneti lesz, és fájdalmat okoz. A kezelés megkezdése előtt figyelembe kell vennünk a beteg meglévő társbetegségeit és a kezelés megkezdésének várható káros hatásait. Betegek korai stádiumú mCRPC a COU-AA-302 tárgyalás, aki kapott abiraterone általában túlélte majdnem egy évvel hosszabb, mint azok, akik placebót kaptak (medián OS, 53.6 hónap vs 41.8 hónap, illetve, HR, 0.61; 95% CI, 0.43, hogy 0.87; P = .006).33 így a korai stádiumú mCRPC betegek részesültek az abirateron korábbi kezdetéből. Ugyanabban a tárgyalás betegek tünetmentes vagy enyhe tünetekkel járó mCRPC, a kiindulási PSA < 15.6 ng/mL abiraterone is eredményezte, hogy a gyorsabb sebesség, nagyobb fokú PSA csökkenés, mint a placebo.34 bár a jelenleg rendelkezésre álló adatok korlátozottak, valószínűleg azt sugallja, hogy a kezelés megkezdése korábban, mint később előnyösebb.33, 34
metasztatikus kasztrát-rezisztens prosztatarák jóváhagyott első vonalbeli kezelési lehetőségei
abirateron
az abirateron egy antiandrogén,amely a 17α-hidroxiláz/C17, 20-lyáz (CYP17) enzim inhibitora. A COU-AA-302 fázis III vizsgálatban az abirateront 1088 kemo-naiv, tünetmentes vagy enyhén tüneti, zsigeri metasztázisok nélküli mcrpc-ben értékelték. Ebben a vizsgálatban a betegeket abirateron-acetátra vagy placebóra randomizálták, mindkettőt prednisone-val kombinálták35 (1. ábra). A betegeket a keleti szövetkezeti onkológiai csoport (ECOG) 0.vagy 1. performance status, valamint tünetmentes vagy enyhén tüneti betegség rétegezte.A 35 OS és a radiográfiai progressziómentes túlélés (rpfs) volt az együttes elsődleges végpont. A tárgyalás bizonyította, hogy miután a medián utánkövetési 22.2 hónap volt jelentős javulást rPFS a abiraterone kar (medián 16.5 vs 8.2 hónap, HR 0.52, p < 0.001). A 49,2 hónapos medián követést követő végső elemzés során az operációs rendszer végpontja szignifikánsan pozitív volt (34,7 vs.30,3 hónap, HR: 0,81, 95% CI: 0,70-0,93, p = 0,0033).36 fontos megjegyezni, hogy az mCRPC széles prognosztikai spektrumot tartalmaz még kemoterápiával nem kezelt betegeknél is.37 a COU-AA-302 vizsgálat abirateron karjának analízisében azok a betegek, akiknél a vizsgálat megkezdésekor nem volt fájdalom, normál alkalikus foszfatáz-és LDH-szint, és 10 csontmetasztázisnál kevesebb, átlagosan 42,6 hónapos volt.37 azonban azoknál a betegeknél, akiknél a progresszió több kockázati tényezője volt, szignifikánsan rövidebb volt a medián OS.37 az abirateron toxicitási profiljának értékelésekor úgy tűnt, hogy a mineralokortikoid felesleggel és a májfunkció rendellenességeivel kapcsolatos további nemkívánatos események jelentkeznek, de ezek többnyire 1-2 mellékhatást jelentettek. Végül az abirateron az idős populációban is ugyanolyan hatékonynak bizonyult (> 75 év).38
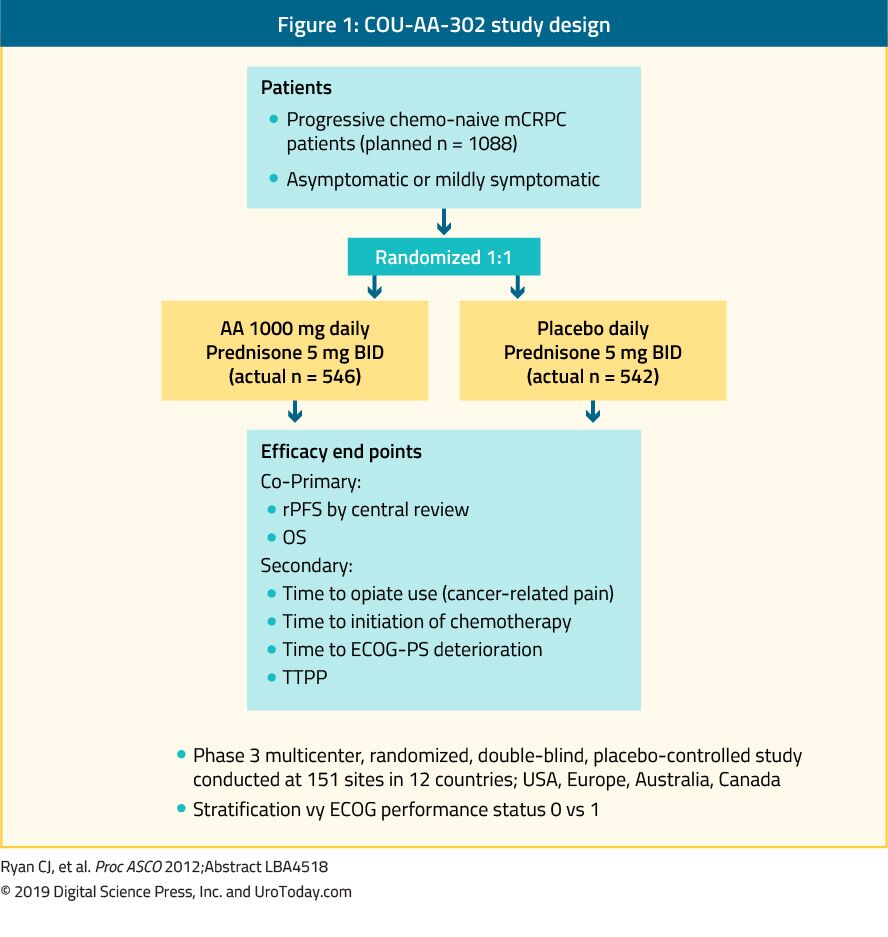
1. ábra. A COU-AA-302 vizsgálati terv
Enzalutamid
az Enzalutamid nem szteroid antiandrogén. A randomizált III. fázisú vizsgálatba 1717 kemo-naiv mCRPC-s beteget vontak be, és visceralis metasztázisban szenvedő betegek is jogosultak voltak.39 ebben a vizsgálatban az enzalutamidot placebóval hasonlították össze(2. ábra). Az IRÁNYADÓ vizsgálat azt mutatta, hogy jelentős javulás enzalutamide kezelt betegeknél mindkét co-elsődleges végpontok, amely tartalmazza rPFS (HR: 0.186; CI: 0.15-0.23, p < 0.0001), az OPERÁCIÓS rendszer (HR: 0.706; CI: 0.6-0.84, p < 0.001). A kiterjesztett nyomon követés és a végső elemzés megerősítette az enzalutamid OS és rPFS előnyösségét.Az enzalutamiddal kezelt betegek 78% – ánál a PSA több mint 50% – os csökkenését jelentették. A leggyakoribb klinikailag releváns mellékhatások a fáradtság és a magas vérnyomás voltak. Az enzalutamid szintén ugyanilyen hatásos és jól tolerálható volt idősebb férfiaknál (> 75 év)41 és zsigeri metasztázisban vagy anélkül.42 a májmetasztázisban szenvedő férfiak esetében azonban úgy tűnt, hogy nincs észrevehető előny.43 A TEREP tárgyalás képest enzalutamide a bicalutamide, egy idősebb antiandrogen, egy randomizált, kettős-vak, fázis II vizsgálatban, amely jelentős javulás a PFS (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
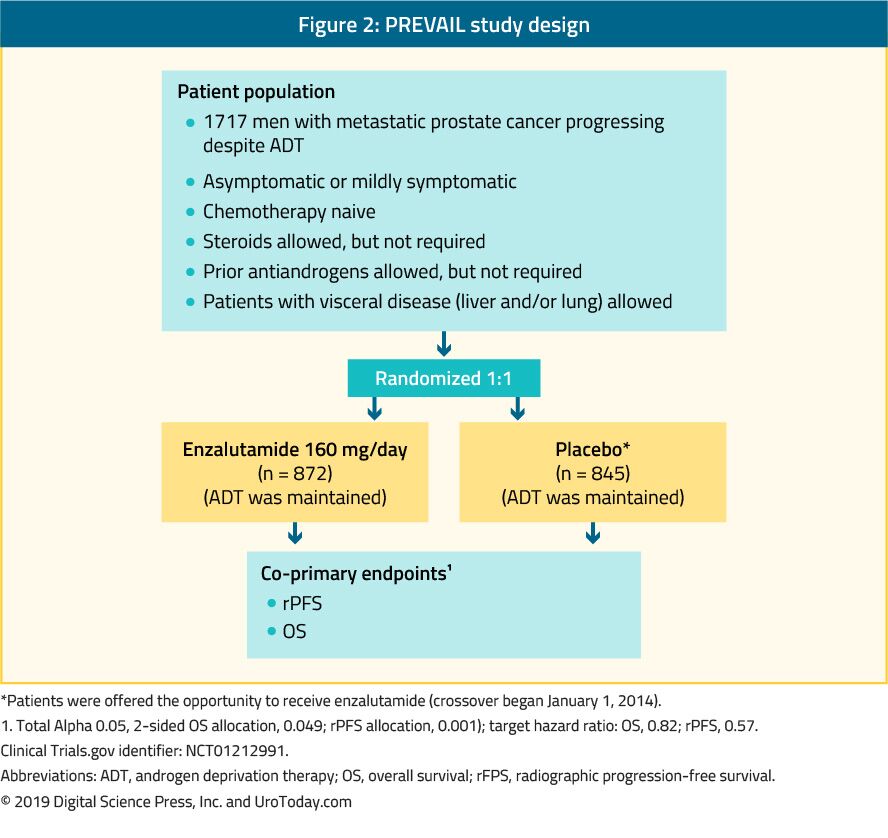
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). A standard elsővonalbeli kemoterápia a docetaxel 75 mg / m2, háromhetente alkalmazott dózisban, napi kétszer 5 mg prednizonnal kombinálva, legfeljebb tíz ciklusban. A docetaxel alkalmazásakor számos fontos prognosztikai tényezőt kell figyelembe venni: zsigeri metasztázisok, fájdalom, vérszegénység (Hb < 13 g/dL), csontszkennelés progressziója és korábbi ösztramusztin terápia. Ezek a prognosztikai tényezők segíthetnek a docetaxelre adott válasz stratifikálásában. Ezeknek a prognosztikai tényezőknek a felhasználásával a betegség alacsony, közepes és magas kockázatú kategóriába sorolható, a medián OS 25-ös becslései jelentősen eltérnek.7, 18, 7, illetve 12, 8 hónap.45 bár az életkor önmagában nem jelenti a docetaxel-kezelés ellenjavallatát, a betegeknek elegendőnek kell lenniük ahhoz, hogy elviseljék az ilyen típusú kezelést, és a kezelés megkezdése előtt értékelni kell a társbetegségeket. A férfiak, akik úgy gondolják, hogy nem tűri a szokásos adag rend szerint docetaxel, ez is csökkent, 75-ről 50 mg/m2 kéthetente, kevesebb grade 3-4 mellékhatások, illetve hosszabb idő kezelés hatástalanná.46
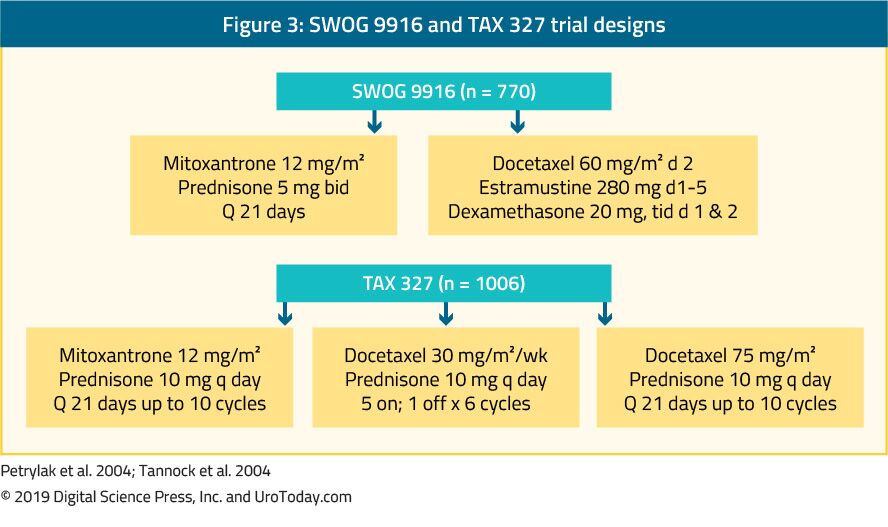
3. ábra. SWOG 9916 ADÓ 327 tárgyalást tervez
Sipuleucel-T
Sipuleucel-T, autológ aktív mobil immunterápia volt látható, egy fázis III vizsgálatban (HATÁS vizsgálat), hogy biztosítanak egy túlélési előny 512 tünetmentes, vagy csak minimálisan tüneti mCRPC betegek képest placebo24 (4.Ábra). Miután medián utánkövetési 34 hónap, a medián túlélés szignifikánsan magasabb volt a sipuleucel-T-csoport (25.8 vs 21.7 hónap, egy HR-es a 0.78,p = 0,03).24 fontos, hogy a kezelés alatt vagy után nem figyeltek meg PSA-csökkenést, és a PFS mindkét karon hasonló volt. A sipuleucel-T-vel szembeni általános tolerancia nagyon jó volt, többnyire 1-2. fokozatú nemkívánatos események fordultak elő. Jelenleg ez a kezelés csak az Egyesült Államokban érhető el, Európában már nem érhető el.
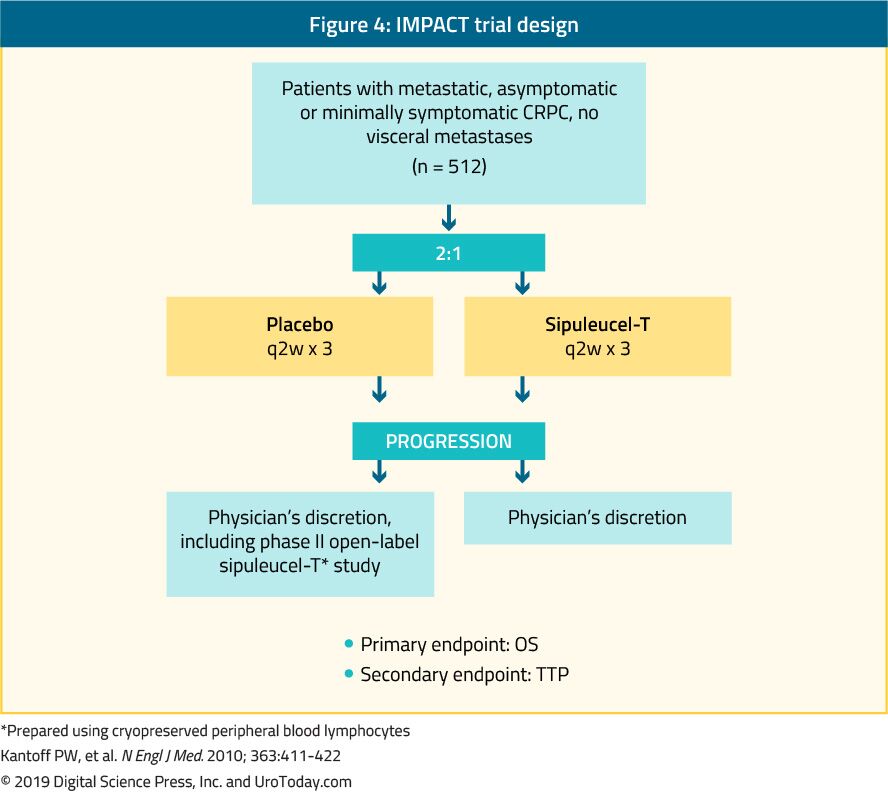
4. ábra. IMPACT trial design
következtetések
az elmúlt 15 évben jelentős tudományos fejlődés és beruházások történtek a gyógyszerfejlesztésben az mCRPC-ben szenvedő betegek számára. Ez azt eredményezte, hogy az FDA jóváhagyása több sor szisztémás terápiák alapján fájdalom palliáció, minimálisra csökkenti a betegség káros hatásait, és OS meghosszabbítása. A mai napig az egyes szerek mindegyikéből származó mcrpc-betegek OS-re gyakorolt jelentett hatása még mindig szerény, ami csak néhány hónap hozzáadását eredményezi. Szükséges a mcrpc betegségbiológiájának megértése, a kasztrációs rezisztencia átfogó molekuláris megértésének integrálása, valamint a jelenlegi terápiákkal szembeni rezisztencia mechanizmusainak elemzése a jövőbeli kezelés fejlődésének javítása érdekében. Fontos továbbá a prediktív biomarkerek befektetése és fejlesztése a terápia személyre szabásának elősegítése érdekében. Végül, egy praktikusabb megjegyzés, több adatra van szükség a megfelelő második és harmadik vonalbeli terápiák, valamint a szekvenálás és kombinációja a rendelkezésre álló gyógyszerek, tárgyalt részletesebben a következő felülvizsgálat cikk (“túl első vonalbeli kezelés metasztatikus kasztrát-rezisztens prosztatarák”).
Megjelenés dátuma: 2019. November 19.
Leave a Reply