1.14 megkülönböztetése: a pH és a PKA
relatív savasság és PKA értékek megkülönböztetése
A Henderson-Hasselbach-egyenlet alkalmazása a vegyületek relatív savasságának meghatározása a PKA-értékek összehasonlításával. Minél erősebb egy sav, annál nagyobb az ionizáció, annál alacsonyabb a pKa, annál alacsonyabb a pH, amelyet a vegyület oldatban termel. Néhány kiválasztott PKA értékek vegyületek a tanulmány a szerves kémia látható ordít. Mivel a szerves reakciók nem vizes környezetben is elvégezhetők, a pH meghaladhatja a 14-et, a szerves vegyületek pKa-értékei pedig a 16-ot is meghaladhatják. Ez egy változata, hogy a vonal a The Wizard of Oz, ” nem élünk a vízben többé.”





nagyon jó ötlet, hogy elkötelezzük magunkat a fenti vegyületek hozzávetőleges pKa tartományainak emlékezetére. Az óvatosság szava: a PKA táblázat használatakor feltétlenül győződjön meg róla, hogy a megfelelő konjugált sav/bázispárt veszi figyelembe. Ha arra kérik, hogy mondjon valamit az ammónia (NH3) bázikusságáról az etoxidionhoz (CH3CH2O -) képest, például a figyelembe veendő releváns pKa-értékek 9,2 (az ammónium-ion pKa) és 16 (az etanol pKa-ja). Ezekből a számokból tudod, hogy az etoxid az erősebb bázis. Ne kövesd el azt a hibát, hogy a 38-as pKa értéket használod: ez a savként ható ammónia pKa, amely megmondja, hogy az NH2 – ion milyen alapvető (nagyon alapvető!)
* megjegyzés a víz pKa-jára: A víz pKa a 14. A biokémia és a szerves kémia szövegei gyakran 15,7-es értékként sorolják fel az értéket. Ezek a szövegek helytelenül igazolták a víz koncentrációjának moláris értékét az egyensúlyi állandóba. Az egyensúlyi állandó helyes származtatása magában foglalja a víz aktivitását, amelynek értéke 1.
példa
bár ez a kurzus egyetlen funkcionális csoporttal kezdődik, végül több funkcionális csoportot tartalmazó érdekes vegyületekkel fogunk dolgozni. Hasznos képesség annak felismerése, hogy mely hidrogének ionizálhatók savas protonokként, és mely hidrogének nem képesek. Ebben a példában vegye figyelembe, hogy a molekula négy különböző helyén ki kell értékelnünk a potenciális savasságot.
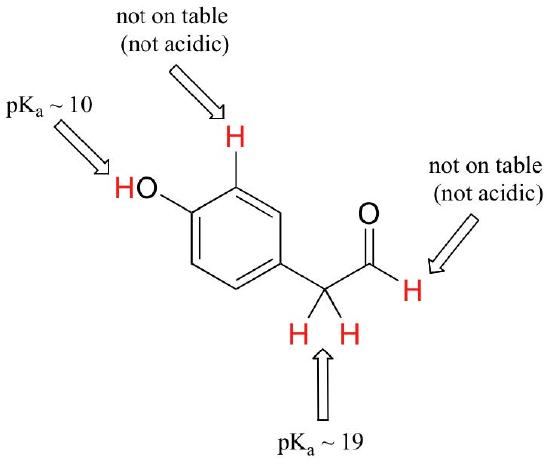
az aldehid és az aromás protonok egyáltalán nem savasak(a pkavaluák 40 felett vannak – nem az asztalunkon). A karbonil melletti szénen lévő két proton enyhén savas, a táblázat szerint a PKA értékek 19-20 körül vannak. A legtöbb savas proton a fenolcsoporton van, tehát ha a vegyületet egy erős bázis egyetlen moláris egyenértékének vetnék alá, akkor ez az adományozott proton.
savas & alapvető környezetek – minden relatív reaktivitás
mivel célunk a dinamikus kémiai reaktivitás megértése, nem kell tudnunk egy vegyület protonált és nem bizonyított formáinak konkrét mennyiségét. Egyszerűen tudnunk kell, hogy melyik forma dominál. Ha a környezet pH-ja kisebb, mint a vegyület pKa-ja, akkor a környezet savasnak tekinthető, és a vegyület túlnyomórészt protonált formában fog létezni. Ha a környezet pH-ja nagyobb, mint a vegyület pKa-ja, akkor a környezetet alapvetőnek tekintik, és a vegyület túlnyomórészt deprotonált formában fog létezni.
például az ecetsav pKa-ja körülbelül 5. Az 1-es pH-értéknél a környezetet savasnak tekintik, az ecetsav pedig túlnyomórészt protonált formában létezik. A 8. pH-nál a környezetet bázikusnak tekintik, az ecetsav pedig deprotonizálódik acetát (CH3CO2 -) formájában. Ezzel szemben a fenol pKa 10. A pH 8-nál a környezet savasnak tekinthető a fenol számára, és elsősorban protonált marad.
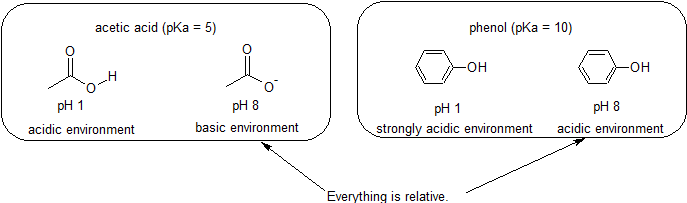
fontos megjegyezni, hogy a szerves kémiának nem kell a vízben előfordulnia, így a pKa értékek akár 50 is lehetnek.
gyakorlat
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
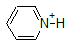 |
 |
 |
 |
 |
 |
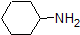 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply