Epigenetikk-det er ikke bare gener som gjør oss
Så Hva er epigenetikk?en annen måte å se på epigenetikk på er slik; mens tradisjonell genetikk beskriver HVORDAN DNA-sekvensene i våre gener overføres fra en generasjon til den neste, beskriver epigenetikk hvordan generene brukes. For å lage en datamaskinanalogi, tenk på epigenetikk som metadata, informasjon som beskriver og bestiller de underliggende dataene. Hvis du eier EN MP3-spiller for eksempel, vil den inneholde mye data, MP3-filer. Tenk på disse som analoge med gener. Men du vil også sannsynligvis ha spillelister, eller du kan spille spor etter artist eller sjanger. Denne informasjonen, spilleliste, artist, sjanger etc. det er metadata. Det bestemmer hvilke spor som spilles og i hvilken rekkefølge, og dette er hva epigenetikk er for genetikk. Det er et sett med prosesser som påvirker hvilke gener som er slått på, eller «uttrykt», som molekylærbiologer vil si.
hvordan fungerer epigenetikk? så epigenetikk handler om hvordan gener uttrykkes og brukes, i stedet FOR DNA-sekvensen av genene selv,men hvordan virker dette? Mange forskere har studert epigenetikk de siste tiårene, og det er for tiden et område med intens forskningsaktivitet. Vi vet at en del av hvordan epigenetikk fungerer, er å legge til OG fjerne små kjemiske koder TIL DNA. Du kan tenke på disse kodene som post-it-notater som fremhever bestemte gener med informasjon om hvorvidt de skal slås på eller av. Faktisk kalles den kjemiske taggen en metylgruppe (Se Diagram 1), og den brukes til å modifisere en av de fire basene Eller «kjemiske bokstaver», A, C, T Og G, som utgjør den genetiske koden til VÅRT DNA. Bokstaven som er merket Er c eller cytosin, og når den er modifisert, eller metylert, kalles den 5-metylcytosin. Metylgrupper legges TIL DNA av enzymer kalt DNA metyltransferaser (DNMTs).
-
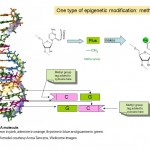
Diagram 1. To kjemiske koder, metyl-og acetylgrupper som er sentrale for epigenetiske fenomener og den kjemiske strukturen av cytosin og 5-metylcytosin I DNA. Den femkantede delen av molekylet danner DEN kontinuerlige «ryggraden» AV DNA . Bare en AV DE TO strengene AV DNA som utgjør den kjente doble helixen, vises.
Dronningbi status bestemmes delvis av færre metylkoder
i de fleste tilfeller resulterer mer metylert Cs i DNA i et gen i at genet blir slått av. Honningbier gir oss et godt eksempel på hvordan dette kan fungere. Arbeiderbier og dronningen har svært forskjellige kropper; dronningen er mye større, lengre levetid, har en forstørret mage og legger mange tusen egg, mens de mindre arbeiderne er sterile, men har komplekse foraging og kommunikasjonsevner. Til tross for dette er dronningen og arbeiderne i en bikube kvinnelige og genetisk identiske. Ledetråden til hvordan dette kommer til, ligger i royal jelly, en sekresjon som er matet til noen utviklende larver, og som resulterer i at disse larvene blir dronninger i stedet for arbeidere. Vi kommer tilbake til royal jelly og dets dronningskapende egenskaper senere, men et fascinerende stykke forskning viste at hvis mengden av metylgruppen som tilsatte DNMT-enzym ble kunstig redusert i bi-larver, utviklet larvene seg til dronninger, selv om de ikke ble matet royal jelly. Dermed kan bryteren mellom dronning og arbeidstaker vendes av overflod av metylkoder på bi-larvens DNA. Færre metylkoder fører til å slå på et spesielt gen eller gener i utviklende larver som resulterer i utvikling av larver i dronninger og ikke arbeidere.
Koder på haler opererer også genbrytere
DNA-metylkoder er bare en del av historien skjønt. I cellene til alle planter og dyr blir DNA pakket eller pakket inn i nukleosomer hvor DNA-dobbeltspiralen er viklet rundt en sentral kjerne av protein (Se Diagram 2). Omtrent 150 bokstaver AV DNA (eller basepar) er pakket rundt hvert nukleosom, og dette bidrar til å pakke de 3 milliarder baseparene av genetisk kode inn i hver av våre celler. Nukleosomer er for små til å se ved hjelp av konvensjonelle mikroskoper, men biologer bruker en teknikk som kalles Røntgendiffraksjon for å utarbeide formen og organisasjonen av objekter som nukleosomer, og i 1997 avslørte denne teknikken den vakre strukturen av nukleosomer ved høy oppløsning – se (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
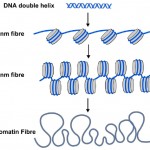
Diagram 2. Den kjente dna double helix (blå) er pakket rundt nukleosomer (grå sylindere) i celler. Strengen av nukleosomer kan vikles inn i et tykkere filament, kalt 30 nm fiber, og dette kan videre vikles inn i en fortsatt tykkere kromatinfiber. Når gener er slått på deres nukleosomer er mer uncoiled som 10nm fiber.
Nukleosomer er kompakte, Men endene eller «haler» av proteinene som utgjør nukleosomet, som kalles histoner, stikker ut fra den ellers kompakte nukleosomstrukturen. Som metylkodene PÅ DNA, kan små kjemiske koder også legges til disse histonhaler (se Diagram 3). To av de kjemiske kodene som legges til disse haler er acetylgrupper og metylgrupper. Metyl, acetyl og noen andre typer koder kan legges til haler i et stort antall kombinasjoner, og dette påvirker om et underliggende gen er slått på eller av. Faktisk kan gener slås rett av (dette kalles silencing), full på, eller et sted i mellom AV DNA metyl koder og histone hale koder. Kombinasjonen AV dna og histon koder kan også påvirke hvor lett et gen er slått på eller av.
-
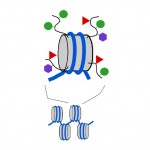
Diagram 3. Kjemiske koder kan legges til» haler » av histonproteiner som utgjør nukleosomer. Grå sylinder, nukleosom; buede svarte linjer, histonhaler; grønne sirkler, metylkoder; røde trekanter, acetylkoder; lilla sekskanter, andre typer tag.
når celler deler
når celler deler seg, blir HELE DNA-sekvensen fra den opprinnelige cellen (3 milliarder basepar inneholdt i 23 par kromosomer i en human celle) duplisert slik at begge dattercellene får en eksakt kopi. Hva, du kan spørre, skjer med alle de epigenetiske kodene? VI har kjent for en stund AT DNA-metylkodene kopieres også, slik at begge dattercellene har samme MØNSTER AV DNA-metylering. Vi vet nå at mønsteret av histonkoder også for det meste dupliseres som celler deler, selv om dette for tiden er mindre godt forstått. Likevel er celledeling også en tid da epigenetiske koder lettest kan endres.
Retur av den langlivede ormen
Helt i begynnelsen kom vi over historien om de langlivede mikroskopiske ormene som passerte på deres levetid til deres avkom, selv om de enkelte avkom ikke arvet variantgenet (mutasjonen) som opprinnelig forårsaket den utvidede levetiden. Vi er nå i stand til å forklare dette tilsynelatende merkelige resultatet. I de fleste tilfeller inneholder gener informasjonen for å lage et proteinmolekyl, og proteinmolekylene kan være enzymer som utfører kjemiske reaksjoner i cellen, eller deler av selve cellens struktur. Det viser seg at genene som ble mutert i ormstudien, gjør proteiner som jobber sammen for å legge til en metyl-tag til nukleosomer. Denne taggen er en på-bryter. Når ett eller flere av genene ble mutert, var denne taggen fraværende og flere gener som skulle være på, inkludert noen involvert i aldring, ble slått av og ormene hadde lengre levetid. Det uventede er at de epigenetiske kodene ble antatt å bli fullstendig slettet eller tilbakestilt under dannelsen av sæd og egg, og så i motsetning til generene selv, bør de ikke overføres til neste generasjon. Men dette resultatet og annen forskning som viser at dette ikke alltid er tilfelle, og at noen ganger blir mønsteret av epigenetiske koder videreført.
Hvordan lage en dronning
Om en larve honningbie blir en arbeidstaker eller en dronning avhenger av en epigenetisk bryter, og denne bryteren ser ut til å være «vendt» av royal jelly. Men hva er det med royal jelly som fører en larve som ellers ville vokse opp til å bli en arbeider, for å bli en dronning? Svaret ligger i å forstå at de enkelte kjemiske kodene som legges til histonhaler av nukleosomer, blir stadig revidert av cellen. Acetylkoder legges til av enzymer som kalles histonacetyltransferaser, og de fjernes eller slettes av en annen gruppe enzymer som kalles histondeacetylaser (HDACs). Begge disse enzymene er tilstede i de fleste celler, og dette gjør at gener kan slås på eller av over tid.
Flere acetyl koder bidra til å levere queen bee status
Nylig, forskere satt ut for å identifisere forbindelser i royal jelly som kan endre denne prosessen, og hva de fant var noe kjent som EN HDAC-hemmer. Dette var en relativt enkel kjemisk forbindelse som er tilstede i royal jelly, og som stopper VIRKNINGEN AV HDAC-enzymer som normalt fjerner acetyl-koder fra histoner. Dette resulterer i en oppbygging av acetyl-koder i cellene i bi-embryoene, og som reduksjonen i DNA-metylgrupper beskrevet tidligere, antas dette å slå på nøkkelgener som kreves for utvikling av en dronning. Uten HDAC-inhibitoren i royal jelly følger larvene et» standard » sett med genetiske instruksjoner og utvikler seg til arbeidere.HDAC-hemmere er ikke bare viktige for dronningbier, MEN er også en del av et lite, men økende antall medisinsk nyttige legemidler som retter seg mot epigenetiske koder og som er nyttige for behandling av enkelte typer kreft. Videre Har HDACs også en rolle i måten hjernen vår danner minner på, og nye stoffer som påvirker histonacetylering, kan ha en rolle i fremtiden ved behandling av hukommelsessvikt hos eldre pasienter.Vi har sett hvordan forskjellen mellom en dronning og arbeiderbi bestemmes av eksponering for et kjemikalie som direkte endrer epigenetiske koder som acetylgrupper; men er det eksempler hvor ernæring eller andre aspekter av miljøet påvirker menneskelige populasjoner på en måte som kan forklares av epigenetikk? Selvfølgelig kan vi ikke gjøre eksperimenter på menneskelige populasjoner som vi kan på mikroskopiske ormer eller bier, men noen ganger gjør menneskets historie eller naturfenomener det for oss. Et slikt eksempel er det som kalles den nederlandske Sultvinteren. I det siste året Av Andre Verdenskrig i Europa resulterte en matembargo pålagt av okkupasjonsstyrkene på sivilbefolkningen I Nederland i en alvorlig hungersnød, som sammenfalt med en spesielt hard vinter. Omtrent 20.000 mennesker døde av sult som rasjoner falt til under 1000 kilokalorier per dag. Til tross for krigens kaos forblir medisinsk behandling og journaler intakt, slik at forskere senere kan studere effekten av hungersnød på menneskers helse. Det de fant var at barn som var i livmor under hungersnøden opplevde en livslang økning i sjansene for å utvikle ulike helseproblemer sammenlignet med barn oppfattet etter hungersnøden. Den mest følsomme perioden for denne effekten var de første månedene av svangerskapet. Dermed ser det ut til at noe skjer tidlig i utviklingen i livmoren som kan påvirke individet for resten av livet.Epigenetiske effekter kan noen ganger passere til barnebarn
enda mer overraskende synes noen data å tyde på at barnebarn av kvinner som var gravide Under Sultvinteren, opplever noen av disse effektene. Fra det vi allerede har diskutert, tyder dette sterkt på en epigenetisk mekanisme. Faktisk fortsetter forskning med de nederlandske Sultvinterfamiliene, og en nylig studie som ser på et gen galled IGF2, fant lavere nivåer av metyl-taggen I DNA av dette genet hos personer utsatt for hungersnød før fødselen. SELV OM IGF2 kanskje ikke selv er involvert i den økte risikoen for dårlig helse hos disse menneskene, viser det at epigenetiske effekter (dvs.reduksjon av antall metylkoder på bestemte gener) som produseres før fødselen, kan vare i mange tiår. Studier på dyr har også funnet ut at morens diett kan ha effekter på hennes avkom. For eksempel, å mate sauer en diett som mangler de typer mat som kreves for å lage metylgrupper, fører til avkom med endrede mønstre AV DNA-metylering og som har høyere enn forventet forekomst av visse helseproblemer.
Epigenetikk og imprinting, hvorfor gener Fra Mamma og Pappa ikke alltid er likeverdige
Vi har alle 23 par kromosomer i cellene våre. For hvert par kom en fra mor og en fra far. Dermed arver vi en kopi av hvert gen fra hver forelder, og vi antar generelt at funksjonen til genet ikke er avhengig av hvilken forelder det kom fra. Men for imprinted gener er ting annerledes. For disse genene er enten mors eller fars kopi av genet aktivt, mens den andre holdes stille. Det er minst 80 påtrykte gener hos mennesker og mus, hvorav mange er involvert i vekst av embryoet eller moderkaken. Hvordan kan en kopi av et gen bli slatt av, mens den andre kopien i samme celle er slatt pa? Svaret er epigenetikk. Sannsynligvis er DET mest studerte imprinted genet IGF2 (se ovenfor). EN DEL AV IGF2 fungerer som en bryter. HVIS DNA er metylert her IGF2 genet kan uttrykkes. Bryteren er bare metylert I Fars kopi av genet, og så er bare denne kopien uttrykt, mens moderkopien er stille. Denne bryteren antas å være satt opp i gametene (egg og sæd), så helt fra starten er gener mottatt Fra Mamma og De Fra Pappa merket annerledes med epigenetiske koder og så er ikke ekvivalente.Angelmann og Prader-Willi syndromer er to forskjellige genetiske tilstander med forskjellige symptomer, begge forårsaket av tap av en del av kromosom 15. Barn som arver en kopi av dette defekte kromosomet utvikler Enten Angelmann eller Prader-Willi syndrom, til tross for at de har en normal kopi av kromosomet fra deres andre foreldre. Så hvordan fører den samme mutasjonen (tap av del av kromosom 15) til disse to forskjellige forholdene? Svaret ligger i oppdagelsen av at denne delen av kromosom 15 inneholder en rekke gener som er trykt, så bare paternal eller maternal kopi av dette genet er uttrykt; hvilken av de to syndromene som vises, avhenger av om slettingen var i mors eller paternalt arvet kromosom. Når det defekte kromosomet er arvet Fra Pappa, er det ingen funksjonell kopi av de trykte gener som er slått av på mors kromosom 15, og resultatet Er Angelmann syndrom og omvendt For Prader-Willi syndrom. Dette er ganske ulikt de fleste genetiske forhold som cystisk fibrose, hvor en effekt på utvikling eller helse bare ses når et mutert gen eller gener er arvet fra begge foreldrene.
Gutter mot Jenter, hvordan slå av et helt kromosom
en bit av genetikk som de fleste av oss vet om er det som gjør en gutt en gutt, og en jente en jente. Det Er x-og Y-kromosomene. Helt i begynnelsen av vår eksistens hver av oss fikk en X-kromosom fra Våre Mødre via egg, og mens jentene fikk en Annen X-kromosom fra sine fedre, via sperm, guttene fikk En Y-kromosom. Y-kromosomet i cellene til et mannlig embryo leder det til å utvikle seg til en gutt, mens med to X og ingen Y-kromosom utvikler det kvinnelige embryoet til en jente. Nå kan du legge merke til at det er en ubalanse her. Vi har alle to hver av alle de andre kromosomene, men for sexkromosomene (X Og Y) har jentene to Xs mens guttene bare har En X (Og En Y). Mens Y-kromosomet inneholder få gener, for det meste involvert i «mannlighet», Inneholder X-kromosomet ganske mange gener involvert i viktige prosesser som fargesyn, blodpropp og muskelfunksjon. For å jevne opp «doseringen» Av X-kromosomgener mellom mannlige og kvinnelige celler, er et Helt X-kromosom slått av i kvinnelige celler. Dette kalles X-kromosom inaktivering og skjer veldig tidlig i livmoren. I denne prosessen slår celler tilfeldig av enten paternal Eller maternal X-kromosom, slik at når en jente baby er født, er kroppen hennes en blanding eller kimær av celler hvor enten mors Eller fars X-kromosom er slått av. Måten dette skjer innebærer typen epigenetiske koder som vi har diskutert, og det har vært kjent i flere tiår at kvinnelige celler inneholder et svært kompakt X-kromosom kalt Barr-kroppen som kan ses under mikroskopet, og dette er det inaktive X-kromosomet.
tilfelle av skilpaddeskall katt
vi er sannsynligvis alle kjent med skilpaddeskall katter og deres spraglete strøk med flekker av oransje og svart pels. Det du kanskje ikke vet er at nesten alle katter med denne typen frakk er kvinner! Årsaken til dette er at et gen for pelsfarge er plassert på kattens X-kromosom. Det er to versjoner av dette genet, kalt » O » og «o»; en gir ingefærpels og den andre svart. To kopier av samme versjon i en hunnkatt resulterer i henholdsvis ingefær eller svart pels, men en kopi av hver gir en skildpaddeffekt. Dette er Ned Til X-kromosom inaktivering. Huden til disse kattene består av flekker av celler hvor enten mors Eller fars X-kromosom er inaktivert. Dette resulterer i hud Med o-genet slått på og o tavlet i noen flekker (oransje pels) og o-genet på og O tavlet i andre flekker (svart pels), derav skilpaddeskallmønsteret. Siden hannkattene bare har Ett X-kromosom, og ingen X-kromosom inaktivering, er de enten oransje eller svarte over alt.Epigenetisk arv, kan epigenetiske tilstander overføres fra en generasjon til den neste?som vi har sett fra rundormseksemplet, kan epigenetiske effekter (i dette tilfellet utvidet levetid) noen ganger overføres fra en generasjon til den neste, selv om effektene bare ser ut til å vare i noen få generasjoner. Er det eksempler hvor epigenetiske effekter overføres til etterfølgende generasjoner hos mennesker eller andre pattedyr? Det er noen bevis på at effekten av den nederlandske Sultvinteren påvirket barnebarn av kvinner som var gravide under hungersnøden. Tilsvarende, i en studie av en 19. århundre nord-svenske befolkningen som gjennomgikk sykluser av hungersnød og masse, mengden av mat tilgjengelig ser ut til å ha påvirket helse og lang levetid på neste generasjon.
hårfarge i mus kan bestemmes av en epigenetisk effekt
Kanskje det mest kjente eksempelet på transgenerasjonelle epigenetiske effekter er gitt av mus Agouti genet. Dette genet styrer hårfarge, og er slått på i akkurat rett tid i hårsekkceller for å produsere en gul stripe i de ellers mørke hårene, noe som resulterer i det som kalles en agouti-pels. Men mus med en bestemt variant Av Agouti-genet kalt Avy har strøk som er hvor som helst mellom gult og det normale mørke (agouti) mønsteret av villtype mus. De gule musene blir også overvektige og lider av andre helseproblemer. Så Avy-genet ser ut til å ha en variabel effekt (faktisk Står Avy for Avariable yellow). Hvordan dette virker har forvirret genetikere i årevis, men vi kan nå gjenkjenne dette som en epigenetisk effekt. Den gule pelsen oppstår fordi Avy-versjonen Av Agouti-genet har defekte kontroller og er slått på hele tiden. Imidlertid blir metylkoder ofte lagt til den defekte KONTROLL-DNA-sekvensen, og dette har en tendens til å slå genet av, noe som resulterer i flettet eller mørk agouti pels i individuelle mus. Valper født til dammer med Avy-genet varierer i farge fra gul til mørk, men andelen avhenger av frakkfargen til moren; kull av mørke (agouti) kvinner er mer sannsynlig å inneholde mørke valper. Videre observeres en høyere andel mørke avkom hvis både mor og bestemor har den mørke fargen. Så agouti-fargingen, som bestemmes epigenetisk (ved antall metylkoder på Avy-genet), kan til en viss grad gjennomføre fra en generasjon til den neste.Selv om Vi kan finne tilfeller der epigenetiske effekter tilsynelatende varer fra foreldre til avkom, er dette vanligvis ikke tilfelle, og nesten alle epigenetiske brytere eller merker tilbakestilles i kimceller (egg og sæd) og i de aller tidligste stadiene av utviklingen av et embryo. Faktisk hvis dette ikke var tilfelle, ville den fantastiske utviklingen av et befruktet egg til en fullt dannet skapning være umulig.Så langt har vi beskrevet noen spesifikke tilfeller av epigenetisk regulering, men vi vet nå at epigenetikk i bred forstand, (hvordan gener uttrykkes og brukes, i stedet for DNA-sekvensen av genene selv) er sentral for hvordan et befruktet egg til slutt kan gi opphav til en hel organisme og hvordan celler av, la oss si huden din, forblir hudceller og er forskjellige fra hjernecellene dine, til tross for at de inneholder nøyaktig de samme genene. Kort tid etter befruktning består et utviklende menneskelig embryo av en ball av celler som kalles embryonale stamceller. Hver av disse cellene har kapasitet til å gi opphav til noen av celletypene i kroppen når embryoet vokser(for eksempel hjerneceller, hudceller eller blodceller). Derimot, 9 måneder senere når en baby er født, er de fleste cellene som utgjør hans eller hennes kropp forpliktet til å være en bestemt type celle med spesifikke funksjoner. Så som cellene deler seg, utvikler ballen av embryonale stamceller gradvis til alle celletyper og strukturer av babyen ved termin. For at dette skal skje, må tusenvis av gener slås på eller av på akkurat de rette tider og i de riktige cellene når et embryo vokser. For eksempel er gener som gjør det fibrøse keratinproteinet som gir huden sin styrke, bare slått på i hudceller og ikke i den utviklende hjernen, og gener som kreves for at hjerneceller skal utvikle seg og gjøre deres sammenkoblinger, er på i hjernen, men ikke i huden.
under utvikling må gener slås ‘på’ og ‘av’. Et veldig stort forskningsområde i dag handler om hvordan alt dette genet slår på en av, og en stor del av denne prosessen bruker epigenetiske kjemiske koder, spesielt acetyl-og metylhiston-koder. For at de embryonale stamceller skal kunne gi opphav til alle de andre celletypene, blir deres epigenetiske brytere (nesten) fullstendig tilbakestilt sammenlignet med voksne celler. Jeg har satt «nesten» i parentes som vi vet fra imprinted gener og transgenerasjonell epigenetisk arv at det er unntak.I februar 1997 ble en sau Kalt Dolly Det mest kjente eksempelet på hennes art, kort og til og med BLITT EN tv-kjendis. Årsaken til hennes berømmelse er at hun var det første pattedyret som ble «skapt» av en prosess som kalles somatisk cellekjerneoverføring, eller med andre ord den første menneskeskapte klonen (menneskeskapte for å være forskjellig fra identiske tvillinger, som er naturlige kloner). Prosessen som førte til fødselen krevde en moden oocyt (et ubefruktet egg) fra en kvinnelig sau og en vanlig celle fra yveret til en annen sau. Først ble kjernen (den DELEN som inneholdt DNA) fjernet fra oocytten. Dette ble gjort ved hjelp av et spesielt mikroskop, da selv om oocytter er ganske store sammenlignet med andre celler, er de fortsatt for små til å se med det blotte øye. Deretter ble kjernen fra yvercellen satt inn i enukleert oocyt. Dermed Hadde Dolly tre «mødre»: donor av oocyten, donor av yvercellen og sauene som bar det utviklende embryoet til sikt. Ingen far var involvert. Selv om denne prosessen var og forblir svært ineffektiv, var det det første beviset på at gener fra en voksen pattedyrcelle kan «epigenetisk omprogrammeres» tilbake til tilstanden til de embryonale stamceller som kan utvikle seg til en hvilken som helst annen type celle. Deretter har den samme prosessen blitt brukt på andre arter og kan ha medisinsk bruk i å generere celler som kan reparere vev skadet av skade eller sykdom.
Oppsummering: mens begrepet «genom» refererer til HELE DNA-sekvensen av en organisme (tre milliarder bokstaver av det for mennesker), refererer epigenomet til hele mønsteret av epigenetiske modifikasjoner på tvers av alle gener, inkludert metyl-DNA-koder, metylhiston-koder, acetylhiston-koder og andre kjemiske koder som vi ikke har nevnt, i hver celletype av en organisme. Dette representerer en nesten ufattelig mengde informasjon, dwarfing selv human genome project. Likevel er kunnskap om epigenomet viktig for å fullt ut svare på noen av de største spørsmålene i biologi som: hvordan utvikler vi oss fra en ball med identiske celler til en hel organisme? hvorfor gjør vi alder? og hvordan kan vi bedre forstå sykdommer som kreft? Ikke overraskende er epigenetikk og epigenom et stort forskningsområde. NOE av forskningen på dette feltet er omfattet AV ENCODE (Encyclopedia OF DNA Elements) prosjektet, en pågående venture for å identifisere mønstre av epigenetiske koder i mange forskjellige typer celler for hele det menneskelige genomet (http://genome.ucsc.edu/ENCODE/). ENCODE-prosjektet sammenlignes noen ganger Med Large Hadron Collider eller LHC I Sveits. LHC er det største vitenskapelige utstyret som er bygget, og eksperimentene fysikeren utfører med det, tar sikte på å undersøke de grunnleggende detaljene i saken som utgjør Vårt Univers. Selv om biologer ikke har (eller trenger) et så spektakulært sett for deres forskning, har innsatsen for å undersøke intricacy av det menneskelige epigenomet blitt sammenlignet MED LHC-prosjektet på grunn av sin skala, kompleksitet og mengden informasjon som blir opprettet.epigenetikk Er et område hvor vår vitenskapelige kunnskap øker raskt. En ting som forskere har oppdaget er at epigenetiske feil er vanlige i sykdommer som kreft og i aldrende celler. Som et resultat utvikler forskere medisiner som retter seg mot defekte epigenomer, og et av de første eksemplene er BRUK AV HDAC-hemmere, som ligner forbindelsen som finnes i royal jelly. Fra studiet av merkelige arvemønstre som genetisk imprinting, den gule/agouti avy-musen, den kvinnelige skilpaddeskallkattpopulasjonen og andre relaterte fenomener har biologer avdekket et helt nytt lag med informasjon som ligger «på toppen» AV DNA-sekvensen av våre gener. Disse nye funnene forklarer disse tidligere underlige observasjonene, men har også stort potensial for ny forståelse og behandling for menneskelig sykdom.
Videre Lesing:
- Fugl, Adrian. Epigenetikk. Øyeblikkelig Ekspert Nr. 29′, New Scientist, 5. januar 2013, nr. 2898.
- Carey, Nessa. Epigenetikkrevolusjonen: Hvordan Moderne Biologi Omskriver Vår Forståelse Av Genetikk, Sykdom og Arv Utgiver: Icon Books. Paperback 1. Mars 2012. ISBN-10: 1848313470. RRP Pris £9-99.
Epigenetisk Påvirkning og Sykdom På Nettstedet:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply