Natriumhydroksid
kemiske egenskaber,anvendelser,produktion
kemiske egenskaber
Natriumhydroksid er et hvidt, lugtfrit, ikke-flygtigt alkalisk materiale, der markedsføres i fast form som pellets, flager, klumper eller pinde. Dens opløselighed i vand er 111 vægtprocent og et damptryk på 0 mmHg (NIOSH, 1994).
Det kan reagere med tricholethylen (TCE) for at danne brandfarligt dichloracetylen og med metaller til dannelse af hydrogengas (OEHHA, 1993). Dens reaktivitet med metaller bør overvejes med hensyn til lagerenheder og containere.
Natriumhydroksid er almindeligt tilgængeligt som en vandig opløsning kendt som kaustisk soda, soda lUD eller simpelt som lUD. Det har forskellige anvendelser, herunder neutralisering af syre; fremstilling af papir, tekstiler, plast, korrosiver, farvestoffer, maling, malingsfjerner og sæbe; raffinering af råolie; galvanisering; metalrensning; hvidvaskning; og opvaskning. En voksende anvendelse har været i den ulovlige fremstilling af methamphetamin.
anvendelser
Natriumhydroksid (NaOH) er en af de mest nyttige industrielle natriumforbindelser. Deter også kendt som lUD eller kaustisk soda og er en af de stærkeste basealkalk (høj pH-værdi)på husholdningsmarkedet. Det bruges som afløbs-og ovnrenser, og det forsæbner fedt ifremstilling af sæbe. Det skal bruges med omhu, fordi det også er i stand til at producere alvorligehudforbrændinger.
beskrivelse
natriumhydroksid, også kendt som lUD og kaustisk soda, er et stærkt kaustisk stof, der bruges i små mængder i kosmetik til at etablere og holde pH af et produkt.Natriumhydroksid er en ekstremt vigtig forbindelse i vores liv, fordi det har så mange anvendelser. Det er en meget almindelig base, der anvendes i den kemiske industri og bruges til mange ting, hvoraf mange forekommer i vores daglige liv. En af de mest kendte anvendelser af Natriumhydroksid er dens anvendelse i unclogging afløb. Det kommer i mange forskellige mærker af afløbsrensere, men en af de mest almindelige er Drano. Det kommer også i form af lud sæbe, som kan bruges til at vaske næsten alt, fra opvasken til dit ansigt.
natriumhydroksidstruktur
ved stuetemperatur er natriumhydroksid et hvidt krystallinsk lugtfrit fast stof, der absorberer fugt fra luften. Det er et fremstillet stof. Natriumhydroksid er en uorganisk forbindelse, der bruges til at kontrollere pH-niveauerne eller tjene som et buffermiddel i kosmetik og produkter til personlig pleje. Det blev historisk brugt i formuleringen af sæber, men ses i øjeblikket i en række formler, herunder badeprodukter, renseprodukter, dufte, fodpulver, hårfarver og farver, makeup, negleprodukter, produkter til personlig renlighed, shampoo, barberingsprodukter, hårfjerningsprodukter, hudplejeprodukter og solbrændingsprodukter samt kemiske glattejern og hårbølgesæt. Det er også en populær ingrediens i industrielle opløsningsmidler som en kemisk base for sæber, ovnrensere, vaskemidler og afløbsrensere på grund af dets evne til at opløse fedt, olier, fedtstoffer og proteinbaserede aflejringer. Mindre hyppigt ses Natriumhydroksid som en ingrediens i tandpastaer.er FDA godkendt, og har modtaget GRAS (generelt anerkendt som sikker) rating som en direkte fødevaretilsætningsstof. Det bruges dog primært til vask og kemisk peeling af produkter. Det er godkendt til brug i kosmetik og produkter til personlig pleje i forskellige koncentrationer: 5 vægtprocent i neglebåndopløsningsmidler, 2 vægtprocent i glattejern til almindelig brug, 4,5 vægtprocent i glattejern til professionel brug, op til en pH 12,7 i hårfjerningsmidler og op til pH 11 i andre anvendelser som pH-justering.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
kemiske egenskaber
Natriumhydroksid, NaOH,også kaldet kaustisk soda eller natriumhydrat(og tidligere kendt som lUD), er et hvidt,massivt, delikat krystallinsk fast stof,der er opløseligt i vand, alkohol og glycerol. Det smelter ved 318 liter C (606 af) og er det mest anvendte og tilgængelige alkaliske kemikalie. De fleste natriumhydroksid fremstilles som et coprodukt af chlor ved anvendelse af elektrolytiske celler;cellerne er af membranen, kviksølv eller membrantype. Nogle natriumhydroksid er markeret som produceret i cellerne;de fleste fordampes og sælges som 50% og 73% opløsninger eller som vandfri perler. De fleste kaustiske slutanvendelser kræver opløsninger med relativt lave koncentrationer. Kaustisk soda anvendes som analytisk reagens og kemisk mellemprodukt, til vaskning og rengøring af bade,til genanvendelse af gummi og olieraffinering, til slukning af bade til varmebehandling af stål,til skæring og opløselige olier,i sæber og rengøringsmidler og til en lang række andre anvendelser.
kemiske egenskaber
NaOH er et hvidt, lugtfrit, delikat materiale, der sælges som pellets, flager, klumper eller pinde. Vandige opløsninger er kendt som sodavand
kemiske egenskaber
Natriumhydroksid forekommer som en hvid eller næsten hvid smeltet masse. Det er tilgængeligt i små pellets, flager, pinde og andre former eller former. Det er hårdt og skørt og viser et krystallinsk brud. Natriumhydroksid er meget delikat og ved udsættelse for luft absorberer det hurtigt kulsyre og vand.
fysiske egenskaber
hvide orthorhombiske krystaller, produceret i form af pellets, klumper, pinde, perler, chips, flager eller opløsninger; hygroskopisk; meget ætsende; absorberer hurtigt CO2 og vand fra luften; densitet 2,13 g/cm3; smelter ved 323 liter C; fordamper ved 1388 liter C; damptryk 1 torr ved 739 liter C og 5 torr ved 843 liter C; meget opløseligt i vand (110 g/100 ml ved stuetemperatur), der genererer varme ved opløsning; vandige opløsninger meget alkaliske, pH på 0,5% opløsning ca.13 og 0,05% opløsning ca. 12; opløselig i methanol, ethanol og glycerol (23,8 g/100 ml methanol og 13.9 g/100 mL ethanol ved omgivelsestemperaturer.).
bruger
kaustisk sodavand er en af de mest anvendtekemikalier. Det bruges til at neutralisere syrer; til at fremstille natriumsalte; til at udfælde metaller som deres hydroksider; i olieraffinering; i forsæbning af estere; til behandling af cellulose, plast og gummi; og i mangesyntetiske og analytiske anvendelser.
anvendelser
Natriumhydroksid sælges kommercielt som vandfri flager eller pellets eller som 50% eller 73% vandige opløsninger. Det har utallige industrielle anvendelser og er et af de 10 bedste kemikalier med hensyn til produktion og anvendelse på verdensplan. 15 millioner tons natriumhydroksid anvendes årligt. Dens største anvendelse, der forbruger omkring halvdelen af sin produktion, er som base i produktion af andre kemikalier. Det bruges til at kontrollere pH og neutralisere syrer i kemiske processer. Papirindustrien gør udstrakt brug af natriumhydrochlorid i masseprocessen. Natriumhydroksid bruges til at adskille fibre ved at opløse det forbindende lignin. Det anvendes på lignende måde i produktionen af rayon fra cellulose. Natriumhydroksid er et nøglekemikalie i sæben industry.In forsæbningsprocessen, triglycerider opnået fra dyr og planter opvarmes i abasisk opløsning for at give glycerol og sæbe:
Natriumhydroksid anvendes i tekstilindustrien til blegning og behandling af tekstiler for at gøredem farvestof lettere. Olieindustrien bruger natriumhydroksid i boremudder og Asa-baktericid. Natriumhypochlorit (NaOCl) anvendes i vid udstrækning til rengøring og som desinfektionsmiddel.5% natriumhypochloritopløsning. Sodiumhypochlorit fremstilles ved at omsætte chlor med natriumhydroksid: Cl2(g) + 2NaOH(AK) – NaOCl(AK) + NaCl(AK) + H2O(l). Natriumhydroksid anvendes i fødevareindustrien til rengøringog skrælning af frugt og grøntsager. Natriumhydroksid er en mindre ingrediens i mange almindeligehusholdningsprodukter, men i nogle få kan det udgøre mere end halvdelen af produktet. Dranokrystaller indeholder mellem 30% og 60% natriumhydroksid, og nogle afløbsrensere kan bestå af 100% natriumhydroksid.
anvendelser
Natriumhydroksid er et alkali, der er opløseligt i vand, med en opløselighed på 1 g i 1 ml vand. det bruges til at ødelægge de bitre kemikalier i oliven, der skal blive sorte oliven. det fungerer også til at neutralisere syrer i forskellige fødevarer.
anvendelser
natriumhydroksid bruges til at justere et produkts pH for at gøre det mere acceptabelt for huden. Det kaldes almindeligvis kaustisk soda og tjener ofte som et kemisk reagens, når man fremstiller sæbe. Hvis det er for koncentreret, kan det forårsage alvorlig hudirritation.
anvendelser
Natriumhydroksid er et af de vigtigste industrikemikalier. I volumen er det i top ti kemikalier produceret i USA. Det bruges til fremstilling af et stort antal forbindelser, herunder flere natriumsalte, til behandling af cellulose til fremstilling af rayon og cellofan og til fremstilling af sæber, vaskemidler, papirmasse og papir. Natriumhydroksid er et almindeligt neutraliserende middel til syrer i syre-base titreringer og olieraffinering. En anden vigtig anvendelse er ekstraktion af metaller fra deres malm, hvor alkalifusion, såsom fusion med kaustisk soda, ofte påføres for at åbne malmen. Derudover bruges natriumhydroksid til at udfælde metaller som hydroksider. Andre anvendelser er til genanvendelse af gummi, opløsning af kasein i plastproduktion, raffinering af vegetabilske olier, forarbejdning af tekstiler, som eluant i ionkromatografi, ætsning og galvanisering og som laboratoriereagens. Også anvendes som en stærk base i mange organiske syntese og base-katalyserede reaktioner.
anvendelser
NaOH-opløsninger bruges til at neutralisere syrer og fremstille natriumsalte, f. eks. i olieraffinering for at fjerne svovlsyre og organiske syrer; til behandling af cellulose ved fremstilling af viskose rayon og cellofan; ved at genvinde gummi for at opløse stoffet; ved fremstilling af plast til opløsning af kasein. NaOH-opløsninger hydrolyserer fedtstoffer og danner sæber; de udfælder alkaloider (baser) og de fleste metaller (som hydroksider) fra vandopløsninger af deres salte. Farmaceutisk hjælp (alkalisator).
fremstilling
Natriumhydroksid fremstilles sammen med chlor ved elektrolyse af natriumchloridopløsning. Forskellige typer elektrolytiske celler anvendes kommercielt. De omfatter kviksølvcellen, membrancellen og membrancellen.
en mættet opløsning af saltlage elektrolyseres. Klorgas frigøres ved anoden og natriumionen ved katoden. Nedbrydning af vand producerer hydrogen-og hydroksidioner. Natrium ion danner NaOH. De samlede elektrolytiske reaktioner kan repræsenteres som:
2na+ + 2CL-+ 2H2O ren Cl2 (g) + H2 (g) + 2NaOH (AK)
kviksølvcellen fortsætter i to trin, der forekommer separat i to celler. Den første er kendt som saltvandscellen eller den primære elektrolysator, hvori natriumionaflejringer på kviksølvkatoden danner amalgam, mens klorgas frigøres ved anoden:
Na+ + Cl– ll Na-Hg (katode) + lll2(g) (anode)
i den anden celle, kendt som nedbrydningscellen, anvendes en grafitkatode, mens natriumamalgam tjener som anoden. Vand reagerer med natriummetallet af amalgam i dekomponeren:
Na-Hg + H2O LH na+ + OH– + LH2 + LH
i chlor-alkalimembranceller anvendes en membran til at adskille chlor frigjort ved anoden fra natriumhydroksidet og hydrogen genereret ved katoden. Uden en membran vil det dannede natriumhydroksid kombinere med chlor til dannelse af natriumhypochlorit og chlorat. I mange celler anvendes asbestmembraner til sådan adskillelse. Mange typer membranceller er tilgængelige.natriumhydroksid fremstilles enten som et vandfrit fast stof eller som en 50% vandig opløsning.
Definition
den vigtigste kommerciellecaustic.
produktionsmetoder
Natriumhydroksid fremstilles ved elektrolyse af saltvand ved hjælp afinertelektroder. Klor udvikles som en gas ved anoden oghydrogen udvikles som en gas ved katoden. Fjernelse af chloridog hydrogenioner efterlader natrium-og hydroksidioner i opløsning.Opløsningen tørres til fremstilling af det faste natriumhydroksid.
En anden metode bruger Kellner–Solvay-cellen. Mættet natriumchloridopløsning elektrolyseres mellem en carbonanode og en flydende kviksølvkatode. I dette tilfælde fremstilles natrium påkatode snarere end hydrogen på grund af parathednatrium til opløsning i kviksølv. Natrium-kviksølvamalgam udsættes derefter for vand, og der produceres en natriumhydroksidopløsning.
reaktioner
Natriumhydroksid er stærkt alkalisk og kan reagere med syrer for at danne salte og vand.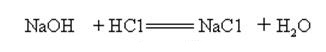
natriumhydroksid reagerer med sure iltninger til dannelse af salt og vand, så natriumhydroksid kan bruges til at absorbere sure gasser i laboratoriet eller industrielt.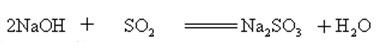
Natriumhydroksid kan reagere med vandige opløsninger af mange metalsalte til dannelse af natriumsalte og metalhydroksider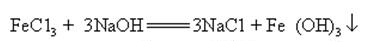
når natriumhydroksid og ammoniaksalt opvarmes sammen, kan det frigive ammoniak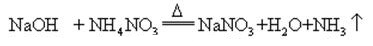
natrium for at forhindre, at en kemisk reaktion åbnes, skal glasflaskerne, der opbevarer natriumhydroksidopløsninger, være gummipropper, og glaspropper bør ikke bruges til at forhindre, at en kemisk reaktion åbnes. Natriumhydroksid er et vigtigt industrielt råmateriale og kan fremstilles ved elektrolyse af saltopløsning industrielt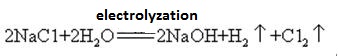
generel beskrivelse
et hvidt fast stof. Ætsende for metaller og væv. Anvendes i kemisk fremstilling, olieraffinering, rengøringsforbindelser, afløbsrensere.
luft & Vandreaktioner
opløseligt i vand. Opløsning kan frigøre nok varme til at forårsage dampning og sprøjt og antænde tilstødende brændbart materiale .
Reaktivitetsprofil
kaustisk SODA (Natriumhydroksid) er en stærk base. Reagerer hurtigt og eksotermisk med syrer, både organiske og uorganiske. Absorberer let fugt fra luften for at give kaustiske halvfaststoffer, der angriber aluminium og sinker med udviklingen af brandfarlig brintgas. Katalyserer polymeriseringen af acetaldehyd og andre polymeriserbare forbindelser; disse reaktioner kan forekomme voldsomt, for eksempel polymeriserer acrolein med ekstrem vold, når de kommer i kontakt med alkaliske materialer, såsom natriumhydroksid . Reagerer med stor vold med fosforpentakilte, når den initieres af lokal opvarmning . Kontakt (som tørremiddel) med tetrahydrofuran, som ofte indeholder peroksider, kan være farligt—eksplosioner er forekommet ved en sådan anvendelse af det kemisk lignende kaliumhydrofuran . Blanding med et af følgende stoffer i en lukket beholder fik temperaturen og trykket til at stige: iseddikesyre, eddikesyreanhydrid, acrolein, chlorhydrin, chlorosulfonsyre, ethylencyanohydrin, glyoksal, saltsyre (36%), flussyre (48,7%), salpetersyre (70%), oleum, propiolacton, svovlsyre (96%) . Utilsigtet kontakt mellem en kaustisk rengøringsopløsning (sandsynligvis indeholdende Natriumhydroksid) og Pentol forårsagede en voldsom eksplosion. . Opvarmning med en blanding af methylalkohol og trichlorobensen under et forsøg på syntese førte til en pludselig stigning i tryk og en eksplosion . Varm og / eller koncentreret NaOH kan forårsage, at hydrokinon nedbrydes eksotermisk ved forhøjet temperatur. (NFPA Pub. 491M, 1975, 385)
fare
ætsende for væv i nærvær af fugt, stærkt irriterende for væv (øjne, hud, slimhindemembraner og øvre luftveje), gift ved indtagelse.
sundhedsfare
stærk ætsende virkning på kontaktede væv. Indånding: støv kan forårsage skade på øvre luftveje og lunger selv, der producerer fra mild næseirritation til pneumonitis. Indtagelse: alvorlig skade på slimhinder; alvorlig ardannelse eller perforering kan forekomme. Øjenkontakt: producerer alvorlige skader.
sundhedsfare
Natriumhydroksid er et stærkt ætsende stofder forårsager skade på humane væv.Dens virkning på huden er noget anderledesfra syreforbrændinger. Der er ingen øjeblikkelig smerte, men det trænger ind i huden. Det koagulerer ikkeprotein for at forhindre dets yderligere indtrængning,og dermed kan den kaustiske forbrænding blive alvorligog langsom helbredelse. Spild af dens koncentreredeopløsninger i øjnene kan resultere i alvorlig irritation eller permanent skade.
det er giftigt ved indtagelse såvel som indåndingaf dets støv. Selvom den orale toksicitet afen 5-10% opløsning af kaustisk soda blev fundetat være lav hos forsøgsdyr, høje doser vedstørre koncentrationer kan forårsage opkastning,udmattelse og sammenbrud. Den orale dødelige dosis hos kaniner er 500 mg / kg (NIOSH 1986).
støv eller aerosoler erirriterende for øjne, næse og hals. Forlængeteksponering for høje koncentrationer i luftenkan producere sårdannelse af næsepassagen.
brandfare
ikke-brændbart, stoffet selv brænder ikke, men kan nedbrydes ved opvarmning for at producere ætsende og / eller giftige dampe. Nogle er iltningsmidler og kan antænde brændbare stoffer (træ, papir, olie, tøj osv.). Kontakt med metaller kan udvikle brandfarlig brintgas. Beholdere kan eksplodere, når de opvarmes.
antændelighed og eksplosivitet
Natriumhydroksid og kaliumhydroksid er ikke brandfarlige som faste stoffer eller vandige opløsninger.
farmaceutiske applikationer
Natriumhydroksid anvendes i vid udstrækning i farmaceutiske formuleringer tiljustere pH af opløsninger. Det kan også bruges til at reagere med svagesyrer til dannelse af salte.
industrielle anvendelser
kaustisk soda (NaOH) betragtes som den stærkeste alkaliske pH-regulator. Kaustisk sodaer et meget aktivt stof og er stærkt ætsende. Størstedelen af kaustisk sodavand fremstillesved elektrolyse af mættede saltvand (NaCl). Kaustisk soda har en meget stærk phreguleringkapacitet (dvs.fra pH 7 til pH 14) ved en relativt lav dosis sammenlignet medandre alkaliske stoffer. Kommercielt er kaustisk soda tilgængelig i vandfri form, men i de fleste minedrift leveres kaustisk soda som en 50% opløsning.
i mineralforarbejdningsindustrien anvendes natriumhydroksid mest til alkalinitetskontrol under behandlingen af ikke-metalliske mineraler. Ved flotation af uædle metaller er brugen afnatriumhydroksid sjældent.
sikkerhedsprofil
gift ved intraperitoneal vej. Moderat Giftig ved indtagelse. Mutationsdata rapporteret. En ætsende irriterende for hud, øjne og slimhinder. Når det opvarmes til nedbrydning, udsender det giftige dampe af NanO.
sikkerhed
Natriumhydroksid anvendes i vid udstrækning i Medicinal-og fødevareindustrien og betragtes generelt som et ikke-giftigt materiale ved lave koncentrationer. Ved høje koncentrationer er det en ætsende irriterende tilhud, øjne og slimhinder.
LD50 (mus, IP): 0,04 g/kg
LD50 (kanin, oral): 0,5 g/kg
potentiel eksponering
NaOH bruges til at neutralisere syrer og fremstille natriumsalte i olieraffinering, viskose rayon; cellofan, plastproduktion; og i genvinding af opløsninger af deres salte. Det bruges til fremstilling af merceriseret bomuld, papir, sprængstoffer og farvestoffer til metalrensning; elektrolytisk ekstraktion af galvanisering; tinbelægning; hvidvask, blegning, opvask; og det bruges i den kemiske industri.
opbevaring
splashgogles og uigennemtrængelige handsker bør altid bæres ved håndtering af disse stoffer for at forhindre kontakt med øjne og hud. Operationer med metalhydroksiderløsninger, der har potentiale til at skabe aerosoler, skal udføres i en fumehood for at forhindre eksponering ved indånding. NaOH og KOH genererer betydelig varmenår den opløses i vand; når du blander med vand, skal du altid tilføje kaustik langsomt tilvand og rør kontinuerligt. Tilsæt aldrig vand i begrænsede mængder til faststofhydroksider. Beholdere af hydroksider skal opbevares på et køligt, tørt sted, adskilt fra syrer og uforenelige stoffer.
opbevaring
Natriumhydroksid skal opbevares i en lufttæt ikke-metalbeholder på et køligt, tørt sted. Når det udsættes for luft, absorberer natriumhydroksid hurtigt fugt og væsker, men bliver efterfølgende fast igen på grund af absorption af kulsyre og dannelse af natriumcarbonat.
forsendelse
UN1823 NaOH, fast, fareklasse: 8; etiketter: 8-ætsende materiale. UN1824 NaOH, opløsning, fareklasse: 8; etiketter: 8-ætsende materiale
rensningsmetoder
almindelige urenheder er vand og natriumcarbonat. Natriumhydroksid kan renses ved at opløse 100g i 1L ren EtOH, filtrering af opløsningen under vakuum gennem en fin sintret glasskive for at fjerne uopløselige carbonater og halogenider. (Denne og efterfølgende operationer skal udføres i en tør, CO2-fri kasse.) Opløsningen koncentreres under vakuum under anvendelse af mild opvarmning for at give en tyk opslæmning af monoalkoholatet, som overføres til en grov sintret glasskive og evakueres fri for moderlud. Efter vask af krystallerne flere gange med renset alkohol for at fjerne spor af vand tørres de i et vakuum med mild opvarmning i ca .30timer for at nedbryde alkoholatet og efterlade et fint hvidt krystallinsk pulver. ÆTSENDE. Natriumhydroksidopløsninger (kaustisk), 14,77. Carbonation kan fjernes ved passage gennem en anionbytningskolonne (såsom Amberlite IRA-400; OH-form). Søjlen skal fremstilles frisk ud fra chloridformen ved langsom forudgående passage af natriumhydroksidopløsning, indtil udløbet ikke giver nogen test for chloridioner. Efter brug kan søjlen regenereres ved vask med fortyndet HCl og derefter vand. På samme måde fjernes andre metalioner, når en 1 M (eller mere fortyndet) NaOH-opløsning føres gennem en søjle af KV-ionbytning a-1-harpiks i sin Na+ – form. Alternativt kan karbonatforurening reduceres ved hurtigt at skylle pinde af NaOH (analytisk reagenskvalitet) med H2O, derefter opløses i destilleret H2O eller ved at fremstille en koncentreret vandig opløsning af NaOH og trække den klare supernatantvæske ud. (Uopløselig Na2CO3 er efterladt.) Karbonatforurening kan reduceres ved at tilsætte et lille overskud af koncentreret BaCl2 eller Ba(OH)2 til en NaOH-opløsning, rystes godt og lade BaCO3-bundfaldet sætte sig. Hvis tilstedeværelsen af Ba i opløsningen er uacceptabel, kan en elektrolytisk oprensning anvendes. For eksempel fremstilles natriumamalgam ved elektrolyse af 3L 30% NaOH med 500 ml rent kviksølv til katode og en platinanode, der passerer 15 Faradays ved 4amps, i en tykvægget polyethylenflaske. Flasken er derefter udstyret med ind-og udløbsrør, hvor den brugte opløsning skylles ud af CO2-fri N2. Amalgamet vaskes derefter grundigt med et stort volumen deioniseret vand (med elektrolysestrømmen tændt for at minimere tab af Na). Endelig anbringes en ren stålstang i kontakt i opløsningen med amalgamet (for at lette hydrogenudviklingen), idet reaktionen får lov til at fortsætte, indtil en passende koncentration er nået, inden den overføres til en opbevaringsbeholder og fortyndes efter behov .
uforligeligheder
en stærk base og en stærk iltningsmiddel. Voldelig reaktion med syre. Uforenelig med vand; brandfarlige væsker; organiske halogener, nitromethan og nitroforbindelser, brændbare stoffer. Absorberer hurtigt kulsyre og vand fra luften. Kontakt med fugt eller vand kan generere varme. Ætsende for metaller. Kontakt med aluminium, tin og bly i nærvær af fugt, der danner eksplosiv brintgas. Angriber nogle former for plast, gummi eller belægninger.
uforligeligheder
Natriumhydroksid er en stærk base og er uforenelig med enhver forbindelse, der let gennemgår hydrolyse eller iltning. Det vilreagere med syrer, estere og ethere, især i vandig opløsning.
bortskaffelse af affald
udledning i tank indeholdende vand, neutraliser, skyl derefter til kloak med vand.
regulatorisk Status
GRAS opført. Godkendt til brug som fødevaretilsætningsstof i Europa.Inkluderet i FDA inaktive ingredienser Database (dentalpræparater; injektioner; inhalationer; nasale, oftalmiske, orale, otiske,rektale, topiske og vaginale præparater). Inkluderet i ikke-parenterale og parenterale lægemidler, der er licenseret i Storbritannien. Inkluderet icanadian liste over Acceptable ikke-medicinske ingredienser.
Leave a Reply