kovalente forbindelser
Du har nu en kort ide om, hvorfor forskellige elementer opfører sig anderledes. Men ved du, at en stor del af det er på grund af “naturen” af bindingerne i forbindelserne. Ligesom du og dine bedste venner har en række forskelle på grund af de “indre” kvaliteter, så er tilfældet med ioniske og kovalente forbindelser. I dette kapitel lærer vi mere om begrebet kovalente forbindelser, ser på deres egenskaber og mere.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Dette skyldes, at atomerne i de kovalente molekyler holdes meget tæt sammen. Hvert molekyle er faktisk ret adskilt, og tiltrækningskraften mellem de enkelte molekyler i en kovalent forbindelse har tendens til at være svag.
Vi kræver meget lidt energi til at adskille molekylerne. Dette skyldes de attraktive kræfter mellem molekylerne med fravær af samlet elektrisk ladning. Kovalente forbindelser er normalt gasformige molekyler ved stuetemperatur og tryk. De kan også være væsker med lave relativt lave kogepunkter.
disse egenskaber kan tilskrives deres svage intermolekylære kræfter, der holder disse atomer sammen. Vi har dog også mange faste kovalente forbindelser. De har lave smeltepunkter. Det er dog interessant at bemærke, at et lille antal af disse har en helt anden struktur. De danner enorme strukturer, hvor et stort antal atomer holdes sammen. Dette er muligt på grund af tilstedeværelsen af delte elektroner.
disse gigantiske molekylære strukturer er dybest set gitter, der består af molekyler, der holdes sammen af kovalente bindingsstruktur. Disse kovalente bindinger er meget stærke. De har også en tendens til at være meget hårde med høje smeltepunkter, der adskiller sig fra de fleste af de kovalente forbindelser. Eksemplet på denne slags kovalente forbindelser indbefatter diamant og grafit af carbonatom netværk. De omfatter også silica af silicium og ilt atomer netværk.
Hent Chemical Bonding Cheat Sheet PDF ved at klikke på knappen Hent nedenfor


gennemse flere emner under Chemical Bonding And Molecular Structure
- bindingsparametre
- fundamentals of chemical bonding
- hybridisering
- hydrogenbinding
- ioniske eller elektrovalente forbindelser
- molekylær orbital teori
- polaritet af bindinger
- resonansstrukturer
- valensbinding Teori
- VSEPR teori
generelle egenskaber af kovalente forbindelser
- kovalente forbindelser har normalt lave smeltepunkter. En undtagelse herfra omfatter molekyler af silica og diamanter, der har et højt smeltepunkt.
- disse forbindelser har lave kogepunkter. Dette kan tilskrives deres svage tiltrækningskraft mellem de forskellige bundne atomer. Van Der Vaals kræfter binder disse atomer.
- disse forbindelser er normalt gasser og væsker med lavt kogepunkt og smeltepunkt.
- de faste kovalente forbindelser har bløde strukturer som grafit. Dette skyldes tilstedeværelsen af en sky af elektroner mellem hvert lag af carbonatomer.
- disse forbindelser er ikke-ledere af elektrisk ladning. Fraværet af ladede ioner er hovedårsagen til dette. En undtagelse herfra er grafit, hvor vi ser en sky af elektroner. Disse gør grafit til en god leder.
- de er også dårlige ledere af varme. Deres molekyler mangler frie elektroner, og det forhindrer strømmen af varmeenergi.
- kovalente forbindelser har ikke polære egenskaber som en generel egenskab. Derfor er disse forbindelser uopløselige i vand. Vandmolekyler er ikke absolut neutrale og har en lille negativ ladning på iltatomet og små positive ladninger på hydrogenatomerne, og da kovalente forbindelser består af neutrale molekyler eller molekyler med små ladninger og derfor ikke tiltrækkes stærkt af vandmolekyler.
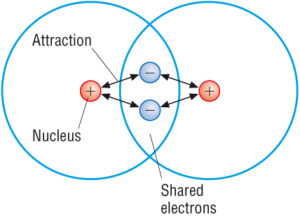
(kilde: Google)
fysiske og kemiske egenskaber
- de flydende kovalente forbindelser fordamper. Dette betyder, at molekylerne af væsker og faste stoffer mister fra deres overflade i luften.
- disse forbindelser har meget mindre affinitet mellem deres molekyler.
- forskellige kovalente forbindelser har deres egne karakteristisk formede molekyler. Deres obligationer er rettet mod forudindstillede vinkler.
- nogle forbindelser, især medicin, er opløselige i vand. Resten er opløselige i olie.
- de fleste af de kovalente forbindelser er ikke-polære eller har meget lidt tendens til at splitte fuldstændigt for at danne ioner og dermed aldrig lede elektricitet.
- ved normal temperatur og tryk finder vi disse forbindelser som enten væsker eller gasser. Men der er også faste stoffer, og de har højere molekylvægte.de kovalente forbindelser krystaller er af to typer: en, der har svag van Der Vaal kraft holder disse sammen som i jod. Disse er let smeltelige og flygtige, den anden har et stort netværk af atomer, der opretter makromolekylerne.disse forbindelser er opløselige i organiske opløsningsmidler som f.eks.
- kovalente bindinger er retningsbestemte. Derfor udviser de fænomenet isomerisme.
- kovalente forbindelser har stort set en meget langsom reaktionshastighed i modsætning til de forskellige ioniske forbindelser.
løst eksempler for dig
spørgsmål: Hvorfor er kovalente forbindelser ikke opløselige i vand?
svar: vandmolekyler er ikke helt neutrale. Disse molekyler har en lille negativ ladning på iltatomet og små positive ladninger på hydrogenatomerne. På den anden side ved vi, at de kovalente forbindelser består af neutrale molekyler eller molekyler med små ladninger. Det er derfor, at disse forbindelser ikke tiltrækkes stærkt af vandmolekyler.
Leave a Reply