9.4:Ionic Bonding
론의 이오니아의 채권을 형성
이온 채권이 형성된 경우 긍정적이고 부정적인 이온은 함께 개최되는 정전기 힘입니다. 한 쌍의 이온,하나의 양이온 및 하나의 음이온을 고려하십시오. 그들의 매력의 힘은 얼마나 강할 것입니까? 에 따라 쿨롱의 법칙,에너지의 정전기 매력을(\(E\))이 입자 크기에 비례의 요금과 반비례하 internuclear 사이의 거리를 입자들(\(r\)):
\
\
각 이온의 청구 기호로 표시됩 Q. 비례한 의견과 동일하 2.31×10-28J·m. 이 값의 k 을 포함 책임의 한 전자(1.6022×10-19C)각 수 있습니다. 방정식은 상수에 통합 된 쿨롱(C)로 표현 된 각 이온의 전하를 사용하여 작성할 수도 있습니다. 이 경우 비례 상수 인 k 는 8.999×109J·m/C2 와 같습니다. 주어진 예에서,Q1=+1(1.6022×10-19C)및 Q2=-1(1.6022×10-19C). 면 Q1 및 Q2 는 반대의 표지판(로 NaCl,예를 들어,Q1 은+1Na+고 Q2-1 에 대한 Cl−),그 E 은 부정적인 것을 의미하는,에너지 발표할 때 반대로 충전이온은 함께 가져서 무한한 거리립된 이온다.
에너지 항상을 출시할 때 유대를 형성하고 이에 대응하여,그것은 항상 필요한 에너지를 끊습니다.
과 같으로 녹색 곡선의 아래쪽에서 그림\(\PageIndex{1}\)최대 에너지는 것을 발표 할 때 이온은 무한히 서로 가까이에서,r=0. 기 때문에 이온 공간을 차지하고 있는 구조를 가진 긍정적인 핵에 의해 둘러싸여 전자,그러나,그들은 무한히 함께 닫습니다. 에서는 매우 짧은 거리,불 전자 전자 사이의 상호 작용 전자 인접한 이온가보다 더 강한 매력적인 간의 상호 작용 이온을 가진 반대편으로 비용과 표시된 빨간색 곡선에서는 상반신의 그림\(\PageIndex{1}\). 시스템의 총 에너지는 매력적이고 반발적인 상호 작용 사이의 균형입니다. 보라색 곡선에 도\(\PageIndex{1}\)는 총 에너지의 시스템에 도달에는 특별한 주의를 기울이시기 바 r0 는 지점이 정전기 repulsions 와 관광 명소로는 정확하게 균형 있습니다. 이 거리는 실험적으로 측정 된 결합 거리와 동일합니다.
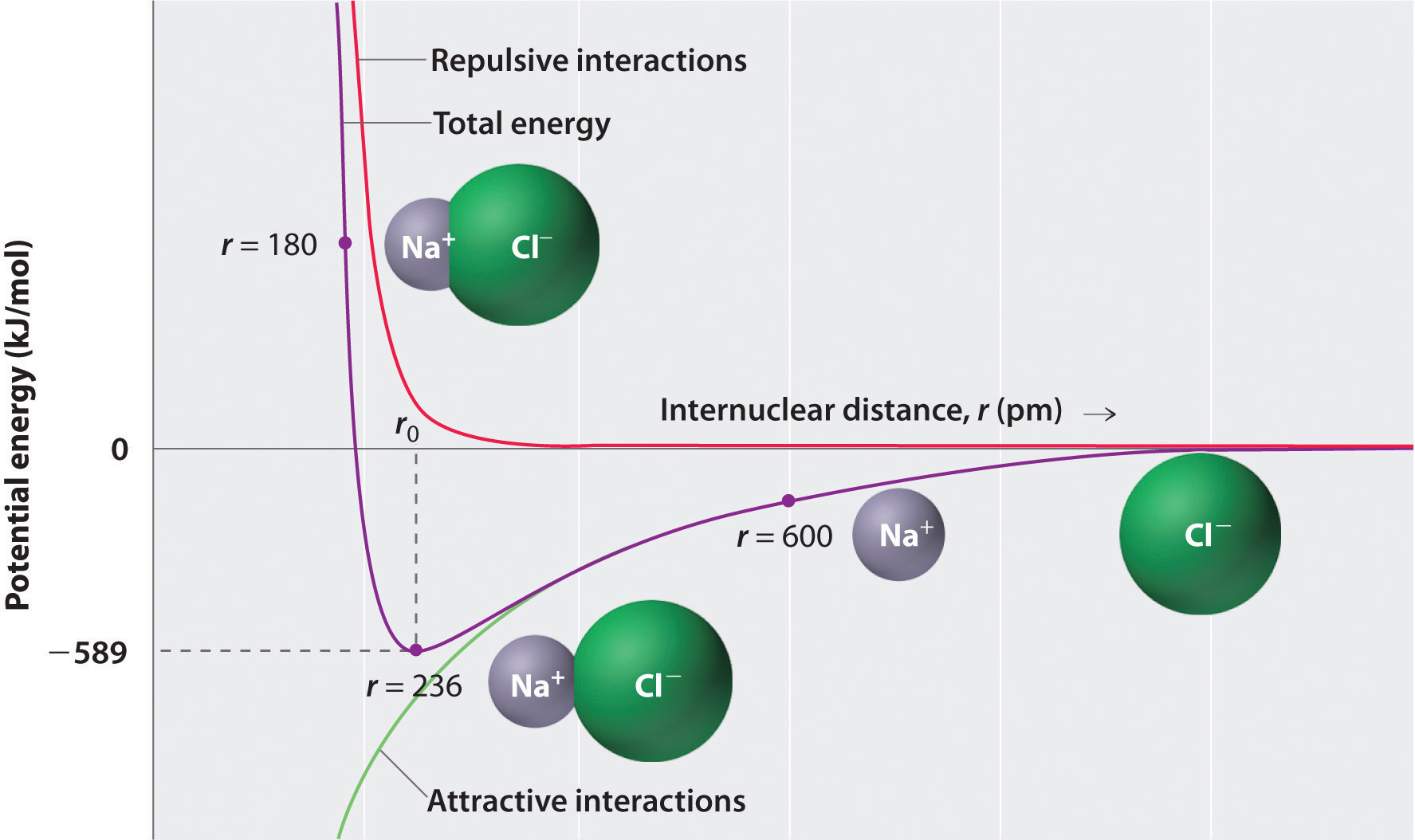
을 고려한 에너지 발표할 때 가스\(Na^+\)이온 및 가스\(Cl^-\)이온은 함께 가져서 r=∞r=r0. 주어진 관찰된 가스 상 internuclear 거리 236pm,에너지 변화의 형성과 관련된 이온 한 쌍에서\(Na^+_{(g)}\)이온 그리고\(Cl^-_{(g)}\)이온은 다음과 같습니다:
\&=(2.31\회{10^{-28}}\rm{J}\cdot\취소{m})\left(\dfrac{( + 1)( – 1)}{236\; \취소{pm}\간 10^{-12}\취소{m/pm}}\right)\\&=-9.79\times10^{-19}\;J/ion\;pair\label{Eq2}\end{align*}\]
음수 값은 에너지가 방출되었음을 나타냅니다. 우리의 협약은 화학 공정이 외부 세계에 에너지를 제공한다면 에너지 변화가 부정적이라는 것입니다. 그것이 에너지를 필요로한다면,에너지 변화는 긍정적입니다. 을 계산하는 에너지 변화의 형성에의 몰 NaCl 쌍,우리가 필요한 증 에너지당 이온 쌍 아보가드로의 번호:
\
이것은 에너지 발표할 때 1mol 기체의 이온 쌍은 형성하지 않을 경우,1mol 의 긍정적이고 부정적인 이온의 응축을 형성 크리스탈고자 한다. 격자 구조에서의 장거리 상호 작용 때문에,이 에너지는 결정질 고체의 격자 에너지와 직접적으로 일치하지 않는다. 그런데,큰 음수 값을 나타내는 데 긍정적이고 부정적인 이온을 함께 정력적으로 매우 유리한 여부,이온 쌍 또는 결정 격자 형성합니다.
우리는 이온 결합에 대한 중요한 점을 요약합니다:
- r0 에서,이온은 무한 내핵 거리에있는 것보다 더 안정하다(낮은 포텐셜 에너지를 가짐). 반대로 하전 된 이온이 r=∞에서 r=r0 으로 함께 모이면 시스템의 에너지가 낮아집니다(에너지가 방출 됨).
- r0 에서 포텐셜 에너지가 낮기 때문에 이온을 분리하기 위해 시스템에 에너지를 추가해야합니다. 필요한 에너지의 양은 결합 에너지입니다.
- 시스템의 에너지는 특정 내핵 거리(결합 거리)에서 최소값에 도달합니다.
예제\(\PageIndex{2}\): LiF
분리 된 이온으로부터 1 몰의 기체 Li+F−이온 쌍이 형성 될 때 방출되는 에너지의 양을 계산합니다. 가스 단계에서 관찰 된 핵 내부 거리는 오후 156 시입니다.
어:양이온 및 음이온,금액,internuclear 거리
요:에 의해 발생하는 에너지를 형성 기체의 이온 쌍
전략:
대신 적절한 값으로 방정식\(\ref{Eq1b}\)을 얻을 출시 에너지의 형성 한 이온 쌍 다음을 곱하여 이 값을 아보가드로의 번호를 얻을 에너지를 발매 당기까지 모든 것을 다루고 있습니다.
솔루션:
값을 삽입을 위한 리+F−식\(\ref{Eq1b}\)(는 Q1=+1,Q2=-1,r=156pm),we 찾을 수 있는 에너지의 형성과 관련된 한 쌍의 리+F−이온
\&=\left(2.31\간 10^{-28} J⋅\취소{m}\right)\left(\dfrac{\텍스트{(+1)(-1)}}{156\; 이\간 10^{-12}\취소{m/pm}}\right)\\&=-1.48\간 10^{-18}\끝{정렬*}\]
그 에너지 몰당 발의 리+F−ion 쌍
\&-891 \;kJ/mol\end{align*}\]
Li+와 F−가 Na+와 Cl-보다 작기 때문에(7.3 절 참조)LiF 의 내핵 거리는 NaCl 보다 짧습니다. 그 결과에 따라 방정식\(\ref{Eq1b}\),훨씬 더 많은 에너지가 출시할 때 1mol 의 기체 리+F−ion 쌍을 형성(-891kJ/mol)때보다 1mol 의 기체 Na+Cl−이온 쌍을 형성(-589kJ/mol).
운동\(\PageIndex{2}\):산화마그네슘
을 계산한 금액을 출시 에너지의 경우 1mol 의 기체\(\ce{MgO}\)이온 쌍을 형성에서 분리온. 가스 단계에서의 핵 간 거리는 오후 175 시입니다.
대답
-3180kJ/mol=-3.18×103kJ/mol
Leave a Reply