1.14:구분 pH 및 pKa
상대적인 산도 및 pKa 값
응용 프로그램의 헨더슨-Hasselbach 방정식을 결정할 수 있는 능력을 갖고 이 상대적인 산의 화합물을 비교하여 그들의 pKa 값입니다. 산이 강할수록 이온화가 커지고 pka 가 낮아지고 ph 가 낮을수록 화합물이 용액에서 생성됩니다. 유기 화학 연구에서 화합물에 대한 일부 선택된 pKa 값은 우는 소리로 표시됩니다. 유기 반응은 비 수성 환경에서 수행 될 수 있기 때문에 pH 는 14 를 초과 할 수 있고 유기 화합물은 16 이상의 pKa 값을 가질 수 있습니다. 그것은 오즈의 마법사에서 그 라인에 변형입니다,”우리는 더 이상 물 속에 살지 않습니다.”

위의 화합물의 대략적인 pKa 범위를 메모리에 커밋하는 것은 매우 좋은 생각입니다. 주의의 단어: pKa 테이블을 사용할 때 올바른 공액 산/염기 쌍을 고려하고 있는지 절대적으로 확신하십시오. 하도록 요구하는 경우에 대해 뭔가를 말합의 염기도 암모니아(NH3)에 비해 ethoxide 이온(CH3CH2O-),예를 들어,관련 pKa 값을 고려해야 할 9.2(pKa 암모늄이온)16(pKa 에탄올). 이 숫자에서 ethoxide 가 더 강한 염기라는 것을 알고 있습니다. 하지 않는 실수를 사용하여 pKa 의 가치 38:이 pKa 암모니아의로 행동산,그리고는 방법을 알려줍니다 기본적인 NH2-이온은(아주 기본적인!)
*물 pKa 에 대한 메모: 물 pKa 는 14 입니다. 생화학 및 유기 화학 텍스트는 종종 값을 15.7 로 나열합니다. 이 텍스트들은 평형 상수로의 물 농도에 대한 몰 값을 잘못 인수 분해했다. 평형 상수의 정확한 파생은 물 의 활동을 포함하며,이는 1 의 값을 갖는다.
예
이론과 함께 시작 단 하나 기능 그룹,우리는 것이 결국 작업과 흥미로운 화합물을 포함하는 여러 기능 그룹이 있습니다. 어떤 수소가 산성 양성자로 이온화 될 수 있고 어떤 수소가 할 수 없는지를 인식하는 것은 유용한 기술입니다. 이 예에서 우리는 분자의 네 가지 다른 위치에서 잠재적 인 산도를 평가할 필요가 있음을 주목하십시오.
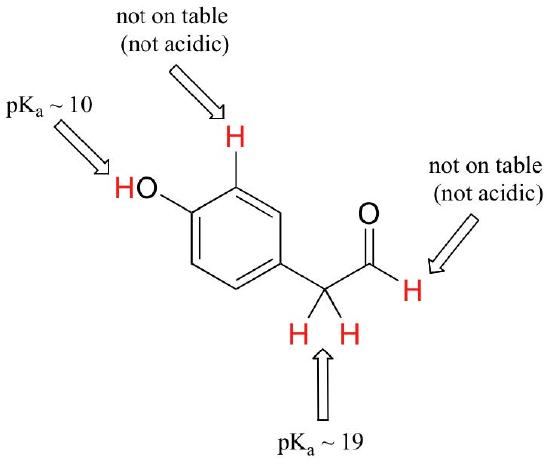
알데히드와 방향족 양성자는 전혀 산성이 아닙니다(pKavalues 는 40 이상–우리 테이블에는 없습니다). 카르 보닐 옆에있는 탄소상의 두 양성자는 표에 따라 pKa 값이 약 19-20 인 약산성이다. 가장 산성 인 양성자는 페놀기에 있으므로 화합물이 강한 염기의 단일 몰 당량을 받게된다면 이것은 기증 될 양성자입니다.
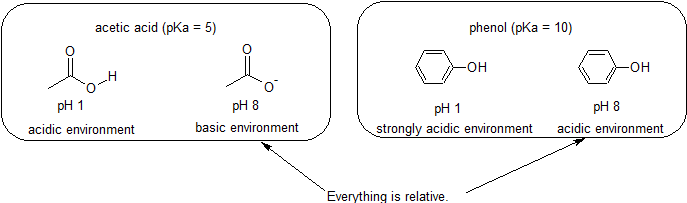
산&기본적인 환경에서-모든 것은 상대적에 반응
우리의 목표이기 때문에 이해 동적 화학적 반응성을 우리는지 알아야 할 특정 금액의 protonated 및 unprotonated 형태의 화합물입니다. 우리는 단순히 어떤 형태가 우세한지를 알아야합니다. 환경의 pH 가 화합물의 pKa 보다 작 으면,환경은 산성으로 간주되고 화합물은 양성자 형태로 우세하게 존재할 것이다. 환경의 pH 가 화합물의 pKa 보다 클 때,환경은 염기성으로 간주되고 화합물은 그 탈 단백질 된 형태로 우세하게 존재할 것이다.
예를 들어,아세트산의 pKa 는 약 5 이다. 1 의 pH 에서,환경은 산성으로 간주되고 아세트산은 양성자 형태로 우세하게 존재한다. PH8 에서,환경은 염기성으로 간주되고,아세트산은 탈 단백질 화되어 아세테이트(CH3CO2-)를 형성한다. 반대로 페놀의 pKa 는 10 입니다. PH8 에서,환경은 페놀에 대해 산성으로 간주되며 주로 양성자로 남아 있습니다.
그것은 또한 기억하는 것이 중요한 유기 화학을 가지지 않에서 발생하는 물서 pKa 값이 높을 수 있 50.운동을하는 것이 좋습니다. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
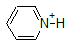 |
 |
 |
 |
 |
 |
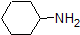 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply