화학 결합
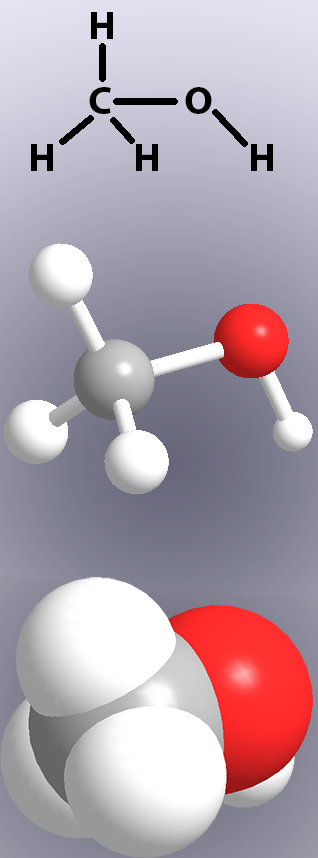
화학 채권은 명소들 간에 원자들을 함께 형성합니다. 거기에 세 가지 주요 형태의 결합:공유 결합하는 바인딩을 함께분자 화합물,이오니아 채권에 바인딩하는 염 및 이온 크리스털,금속 및 채권에 바인딩하는 원자의 금속입니다.
분자와 공유 결합
대부분의 연료,플라스틱 및 천연 제품은 분자 화합물의 원자를 함께 결합으로 분자. 형의 결합에 합류의 원자 분자가 공유결합,결합 할 때 발생하는 외부의 전자 두 원자가 그들 사이에 공유를 만드는 매력의 사이에 두 개의 원자를 함유하고 있습니다.
공유 결합은 다음과 같 화학 구조물의 선으로(그림 1 위)및에서는 모델에 의해 하나 보여주는’지팡이’또는 중첩의 원자(그림 1,중,하).
공유 결합의 전자가 항상 두 원자 사이에서 동등하게 공유되는 것은 아닙니다. 공유가 불평등 할 때,하나의 원자는 매우 약간의 양전하를 띠고 다른 원자는 약간 음수가 될 것이다. 이것은 작은 전기 쌍극자를 크레이트합니다-쌍극자를 포함하는 분자는 극성 화합물입니다. 분자가 극성 또는 무극성인지 여부는 용융 및 끓는점 및 수소 결합과 같은 특성에 영향을 미칩니다.
화학 리브레 텍스트에서 공유 결합에 대해 자세히 읽어보십시오.
이오니아와 금속의 접합
는 동안 공유 접합을 포함한 공유하는 전자 사이에 두 개의 원자,이온 결합을 포함한 완전한 전송 전자의 하나에서 원자를 다른을 만들고,긍정적이고 부정적인 이온. 이 이온은 그 때 그들의 반대 요금 사이 매력에 의해 함께 붙듭니다. 이온 성 화합물은 이러한 매력을 기반으로 결정을 형성합니다.
금속의 접합을 포함한 완전한 공유의 원자의 전자의 금속 원자가를 만드는”전자는”바다에서는 전자는 자유롭게 이동할 수 있습니다. 이것은 금속의 높은 전도성에 대한 이유의 일부입니다. 에 대한 자세한 금속을 접합에서 화학 LibreText
에너지 및 화학 채권
일반적으로,에너지가 출시되면 채권의 형태로 사이에 두 개의 원자,유형에 관계 없습니다. 마찬가지로,결합이 이미 두 원자 사이에 존재한다면,그것을 깨기 위해서는 에너지가 필요할 것이다. 결합을 끊는 데 필요한 에너지의 양은 그것이 형성 될 때 방출되는 에너지의 양과 같습니다.
대부분의 화학 반응은 화학 결합의 파괴와 제작을 모두 포함합니다. 는 경우에 발생하는 에너지를 형성하여 새로운 채권보다 높은 에너지를 파괴하는 데 필요한”old”채권,에너지 발표 될 것이 전반적으로 반응입니다. 이 에너지는 열로 손실되거나 전력에 사용될 수 있습니다.
예를 들어,메탄(CH4)의 연소는이 화학 반응을 따른다:
이 반응은 메탄에서의 4 개의 탄소-수소 결합과 O2 에서의 산소-산소 결합의 파괴를 포함한다. 형성된 새로운 결합은 2 개의 탄소-산소 결합(CO2 에서)과 수소-산소 결합(H2O 에서)이다. 이 새로운 채권은 원래 채권보다 전체적으로 에너지가 적기 때문에이 반응에 의해 에너지가 방출 될 것입니다. 에너지를 방출하는 것은 연소 반응의 특징입니다-당신은 뜨거운 불꽃을 느낄 때 이것을 알아 차렸을 것입니다. 아래의 애니메이션은 메탄의 탄화수소 연소를 보여줍니다.
메탄과 같은 탄화수소의 연소에서 CO2 와 H2O 를 형성 할 때 많은 양의 에너지가 방출되기 때문에 이들은 좋은 1 차 에너지 원입니다. 그것은 또한 많은 양의 에너지 필요한 것이 채권을 휴식 CO2 과 형태의 다른 분자. 이것은 광합성이 이산화탄소를 탄수화물로 전환시키기 위해 너무 많은 에너지(햇빛으로부터)를 필요로하는 이유 중 하나입니다.
에 대한 추가 읽기
- 화학적 에너지
- 연소
- 주요 에너지
- 에너지 변환 기술
- 나 탐구 임의의 페이지
Leave a Reply