화학:산과 염기는 무엇입니까?
산과 염기는 무엇입니까?
하지만 내가 말하는 산 및 기 어렵지 않아 이해하고,나는 나쁜 뉴스:하지 않는 한 일반적인 정의를 설명하는 데 사용되는 산과 염기:계좌는 잔산 및 기초,Brnsted-라산 및 기초,루이스산과 기초입니다. 하지만 이것은 그 소리로 당신이 배워야에 대한산과 기초,세 번 좋은 뉴스를 위한 많은 실용적인 목적으로,이러한 세 가지 정의는 대략 동일합니다.
방법으로 다시 1800 년대 후반에,우리의 오래된 친구 Svante 계좌는 잔했으로 정의산과 기지에서 작업하는 동안 반응 속도론 문제입니다.
Arrhenius 에 따르면,산은 물 속에서 분해되어 hydronium(H+)이온을 방출하는 화합물입니다. Arrhenius 산의 일반적인 예는 염산(HCl)입니다:
- HCl? H++Cl-
산에 대한 공식은 일반적으로 수소로 시작하지만 유기산은 주목할만한 예외입니다. 이름 그리고 수식의 몇 가지 일반적인산에 있어서 아래 테이블:
| 산 이름 | 식 |
|---|---|
| 염산 | HCl |
| 질산 | HNO3 |
| 인산 | H3PO4 |
| 황산 | H2SO4 |
| 아세트산 | C2H4O2 |
기초 계좌는 잔로 정의되는 화합물의 형성을 일으킬 수산화물이온 경우 위치에 물. Arrhenius 염기의 한 예는 수산화 나트륨(NaOH)입니다:
- NaOH? Na++OH-
기본에는 일반적으로 예외가 있지만 수식에”OH”가 있습니다. 예를 들어,암모니아(NH3)는 수산화 이온을 함유하지 않지만 물 과 반응 할 때 형성됩니다.
- NH3+H2O? NH4++OH-
일부 공통 염기의 이름과 공식은 다음 표에 있습니다:
| 이름 | 식 |
|---|---|
| 암모니아 | NH3 |
| 칼륨 수산화 | 코 |
| 중탄산나트륨 | NaHCO3 |
| 나트륨 탄산칼 | Na2CO3 |
| 나트륨 수산화 | NaOH |
일부 양식을 산화물 산 또는 기을 때 물이 추가됩니다. 물과의 반작용하지 않는 한 이 화합물은 어떤 h+또는 OH 이온도 포함하지 않기 때문에,”무수 화합물 불립니다.”일반적으로,산화물의 비금속는산무수물(그들은 형태로 산에 위치할 때 물고),산화물의 금속 base 무수물(성형하는 기지에 위치한 물).
에서 1900 년대 초반 대체에 대한 정의산과 기지에 의해 제안되었 요하네스 Brnsted 및 토마스 로우리 사실을 고려하여 암모니아는 산성을 중화할 수 있의 HCl 경우에도 물 존재하지 않습니다. 이 현상은 수산화 이온을 형성하기 위해 주변에 물이없는 경우에도 암모니아가 염기임을 보여주었습니다.
는 많은 다른 이름과식을 설명하는 데 사용되는 hydronium 수 있습니다. 수식은 이전에”H+”로 표시되었지만 H+가 물과의 결합시 형성되는 이온이기 때문에”H3O”로 쓰여지는 경우가 있습니다. 하이드로 늄 이온을 언급하는 또 다른 일반적인 방법은 단지”양성자”라고 부르는 것입니다.”이 이름에서 오는 사실 H+나타내는 수소 원자(중 하나는 양성자 및 한 개의 전자)을 잃은 전자를 떠나,베 양성자 뒤에 있습니다.
Brnsted-Lowry acid 는 다른 화합물에 hydronium 이온을 제공하는 화합물로 정의됩니까?예를 들어,염산은 반응하는 화합물에 H+이온을 부여합니다. Brnsted-Lowry 염기는 hydronium 이온을 받아 들일 수있는 화합물입니까?암모니아가 hcl 에서 hydronium 이온을 얻을 때,그것은 암모늄 이온을 형성합니다.
다음 방정식은 Brnsted-Lowry 염기와 Brnsted-Lowry 산의 반응을 나타냅니다.
- HNO3+NH3? NO3-+NH4+
이 반응에서 질산은 암모니아에 양성자를 제공하기 때문에 산으로 작용합니다. 암모니아는 질산으로부터 양성자를 받아들이 기 때문에 염기로 작용합니다.
그러나 방정식의 다른면을 살펴보면 질산염과 암모늄 이온을 찾습니다. 기 때문에 질산이온을 받아들일 수 있는 양성자에게서 암모늄이온(을 형성 HNO3),질산이온이 매우 약한 Brnsted-라 base. 암모늄 이온은 기증 할 여분의 양성자를 가지고 있기 때문에(이 경우 질산염 이온에)Brnsted-Lowry 산입니다.
질산 이온은 질산 분자를 기반으로하므로 질산의 공액 염기라고 말합니다. 마찬가지로,암모늄 이온은 암모니아의 공액 산이다. 함께,그의 공액 염기(예:HNO3 및 NO3-)를 갖는 산 또는 그의 공액 산(예:NH3 및 NH4+)을 갖는 염기는 공액 산-염기 쌍으로 지칭된다.
에 Brnsted-라의 정의산과 기지 기본으로 정의 화합물을 받아들일 수 있는 양성자. 그러나 양성자를 어떻게 받아들입니까?
Brnsted-Lowry 염기가 서로 공통적으로 가지고있는 한 가지 특징은 공유되지 않은 쌍의 전자를 가지고 있다는 것입니다. Hydronium 이온이 분자에 의해 방황하게 올 때,때때로 고독한 쌍은 밖으로 도달하고 그것을 움켜 잡을 것이다. 예를 들어 이 경우 암모니아지는 양성자 산성 솔루션:
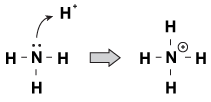
그림 23.1 암모니아는 고독한 전자 쌍으로 질산으로부터 양성자를 잡을 수 있습니다.
이 과정을 보는 한 가지 방법은 암모니아 원자가 양성자에 고독한 쌍을 기증하고 있다는 것입니다. 기 때문에 고독한 쌍이 운전이 화학 반응,우리는 새로운 정의 산성과 염기,소위”루이스는 산성/염기.”루이스 염기는 다른 화합물(우리의 예에서 암모니아)에 전자 쌍을 기증하는 화합물이다. 루이스 산은 전자 쌍(우리의 예에서 H+이온)을 받아들이는 화합물입니다.
루이스 기지를 수 있는 화학 물질에 기부 전자 쌍이다. 루이스 산은 그들을 받아 들일 수있는 화학 물질입니다.
하지만 우리는 암모니아 기부하는 외로운 쌍을 양성자에서 우리를 들어,고독한 쌍 암모니아에 대응할 수 있습과 다른 많은 화합물뿐만 아니라. 예를 들어,암모니아 기부할 수 있는 고독한 전자의 쌍을 BH3 여 다음 프로세스가:

그 23.2 고독한 쌍에 암모니아는 자체를 부착하 BH3.
이 과정에서 암모니아는 루이스 염기이고 BH3 는 루이스 산이다.
일반적으로,루이스의 정의 산 및 기가 가장 유용하기 때문에 그것이 가장 인클루시브의 세 가지 정의입니다. 예를 들어,Brnsted-라 정의한산을 포함 HF 지 BH3 는 잃지 않는 양성자에 의해 연결할 때 고독한 쌍에 루이스 기초입니다.
Ian Guch 의 화학 2003 에 대한 완전한 바보의 안내서에서 발췌. 모든 권리는 어떤 형태로든 전체 또는 부분적으로 재생산의 권리를 포함하여 보유됩니다. 펭귄 그룹(미국)Inc 의 회원 인 Alpha Books 와의 배열에 의해 사용됩니다.
이 책을 출판사에서 직접 주문하려면 Penguin USA 웹 사이트를 방문하거나 1-800-253-6476 로 전화하십시오. 이 책을 구입할 수도 있습니다 Amazon.com 그리고 반스&노블.나는 이것이 어떻게 작동하는지 이해하지 못한다.
Leave a Reply