첫 번째 라인 치료를 위한 전이성 거세-저항하는 전립선암
2019 년에는 전립선암(PCa)계정을 거의 1 에서 5 개의 새로운 진단 암의 남성에서 미국에서.1 지난 몇 년 동안 전체 전립선 암(PCa)발병률은 연간 약 7%감소했습니다.1 발병률의 급격한 하락은 일반적으로 2008 년부터 2013 년까지 전립선 특이 항원(PSA)검사 감소에 기인 한 것입니다. PSA 스크리닝의 사용 감소는 일상적인 PSA 스크리닝에 대한 미국(미국)예방 서비스 태스크 포스 권고에 의해 야기되었다. 이 급료 D 추천 특히 남자에서 75 년 이상는 2008 년에,그리고 나중에 확장된 모든 사람에게 2011 년,상승으로 인해의 우려 overdiagnosis 고 스팟은.2 지만 유의한 PSA 시험 중단 감소하고 안정된 2013 년에서 2015,3 의 효과 심사 감소에서의 발생된 질병은 여전히 불투명하다. Analysis 의 큰 암 레지스트리를 덮고 89%는 미국 인구의 보고는 전반적인 쇠퇴에서 PCa 발생,사실에서,마스크가 증가 먼 단계의 진단에서 2010 년에 걸쳐 나이다.4
주어진 치료법에 관계없이,국소화 된 PCa 환자의 약 20%-30%가 전이성 질환으로 진행되며 일반적으로 호르몬 요법으로 치료됩니다.5 이것은 외과 적 거세(양측 orchiectomy)또는 안드로겐 박탈 요법(ADT)을 이용한 의학적 거세를 통해 주어질 수 있습니다. 모두 방법을 달성하는 거세 수준의 혈청되는 테스토스테론으로 간주 치료의 표준 치료를 위한 전이성 호르몬 민감 PCa(mHSPC). 그러나 mHSPC 는 전이성 거세 내성 전립선 암(mCRPC)으로 진행될 운명입니다.6 거세-저항하는 전립선암(CPC)상태가 정의된 대로 질병의 진행에도 불구하고 도달하는 거세한 테스토스테론 레벨(혈청 테스토스테론<50ng/dL or1.7nmol/L)및 수 있는 현재 중 하나로 지속적인 상승은 혈청 PSA 수준,진행하의 기존병 및/또는 모양의 새로운 metastases.7CRPC 는 평균 생존율이 약 3 년입니다.8 이며 삶의 질이 크게 저하되는 것과 관련이 있습니다.9mHSPC 에서 mCRPC 로의 전환의 정확한 메커니즘은 여전히 불분명하다. 그러나,그것은 잘 알려진에도 불구하고 거세한 수준의 안드로겐,안드로겐 수용체(AR)활성 상태로 유지하고 계속 드라이브 PCa 에서 진행 CPC.10 이것은 안드로겐 생산을 더 감소 시키거나 AR 기능을 차단하는 것을 목표로하는 새로운 약제의 개발을 가져왔다. 그러나,안드로겐 신호 전달과 독립적으로 기능하고 또한 CRPC 를 초래하는 다른 생물학적 경로가 있습니다.
몇 가지 중요한 변화 에서 발생한 처리 옵션의 mHSPC 공간의 결과로 실질적 생존 혜택(“을 참조하십시오 빠르게 진화하는 경영 전략의 전이성 호르몬 민감한 전립선암 링크”)등의 소개는 화학요법에 CHAARTED study11 스탬피드 평가판,12 의 추가 abiraterone 아세테이트와 프레드니손에 위도 study13 스탬피드 평가판,14 의 추가 enzalutamide 에서 아치 trial15 및 ENZAMET 연구,16 그리고 마지막으로,첨가 apalutamide,구두 nonsteroidal-안드로겐 좋아하는 enzalutamide 는 AR 의 리간드 결합 도메인에 직접 결합하고 AR 전좌,DNA 결합 및 AR 매개 전사를 방지합니다.17TITAN 재판은 apalutamide 치료 mHSPC 환자에서 전반적인 생존(OS)이점을 보여 주었다.18Apalutamide 는 또한 다음과 같 혜택을 통해 위약에 비 전이성 CPC(nmCRP)설정에는 스파르타 단계 3 위약 대조,19 와 유사한 혜택을 표시하여 enzalutamide 처리 nonmetastatic 거세-저항하는 전립선암(nmCRPC)환자에서 번영 trial20(참조하시기 바랍에”새로운 치료가 아닌 전이 거세-저항하는 전립선암 링크”). 이러한 치료의 발전에 mHSPC 및 nmCRPC 설정해야의 질문을 제기하는 처리 옵션을 제공할 수 있는 환자에서 mCRPC 설정입니다.21
CRPC 를 가진 남자의 처리는 극적으로 지난 15 년간 변화했습니다. 2004 년 이전에 환자가 1 차 ADT 에 실패했을 때,치료는 완화를 위해서만 투여되었다. Tannock 등의 랜드 마크 시험.22 및 Petrylak 등.2004 년 23 명은 mCRPC 환자에서 도세탁셀 화학 요법을 처음 도입 한 것으로 나타 났으며 생존율을 향상시키는 것으로 나타났습니다. 그러나,이후 docetaxel 었 FDA 승인되는,오는 추가 유익한 에이전트에 보여주는 생존을 활용되었는 FDA 의 승인을 기반으로 무작위로 임상 시험(표 1). 이들을 포함 enzalutamide 및 abiraterone 는 특별히 영향을 미치 안드로겐 축 sipuleucel-T 을 자극하는 면역 시스템;24cabazitaxel 는 또 다른 화학요법 agent;25 듐-223 한,방사성 핵종 치료입니다.26 는 다른 처리를 위해 mCRPC 을 표하고 성과를 개선하는 하지만 아직 FDA 에 의해 찬성되었습니다 및에서 논의 될 것이다 다른 검토합니다. 때문에서 상당한 증가는 여러 FDA 승인 치료제에서 가진 환자 CPC,임상의 도전의 과다와 함께 처리 옵션과 다양 잠재적인 이러한 시퀀스 에이전트 만들기,임상 의사 결정에 mCRPC 훨씬 더 복잡합니다.
표 1. 에이전트가 승인되었습의 처리를 위한 전이성 거세-저항하는 전립선암에서 우리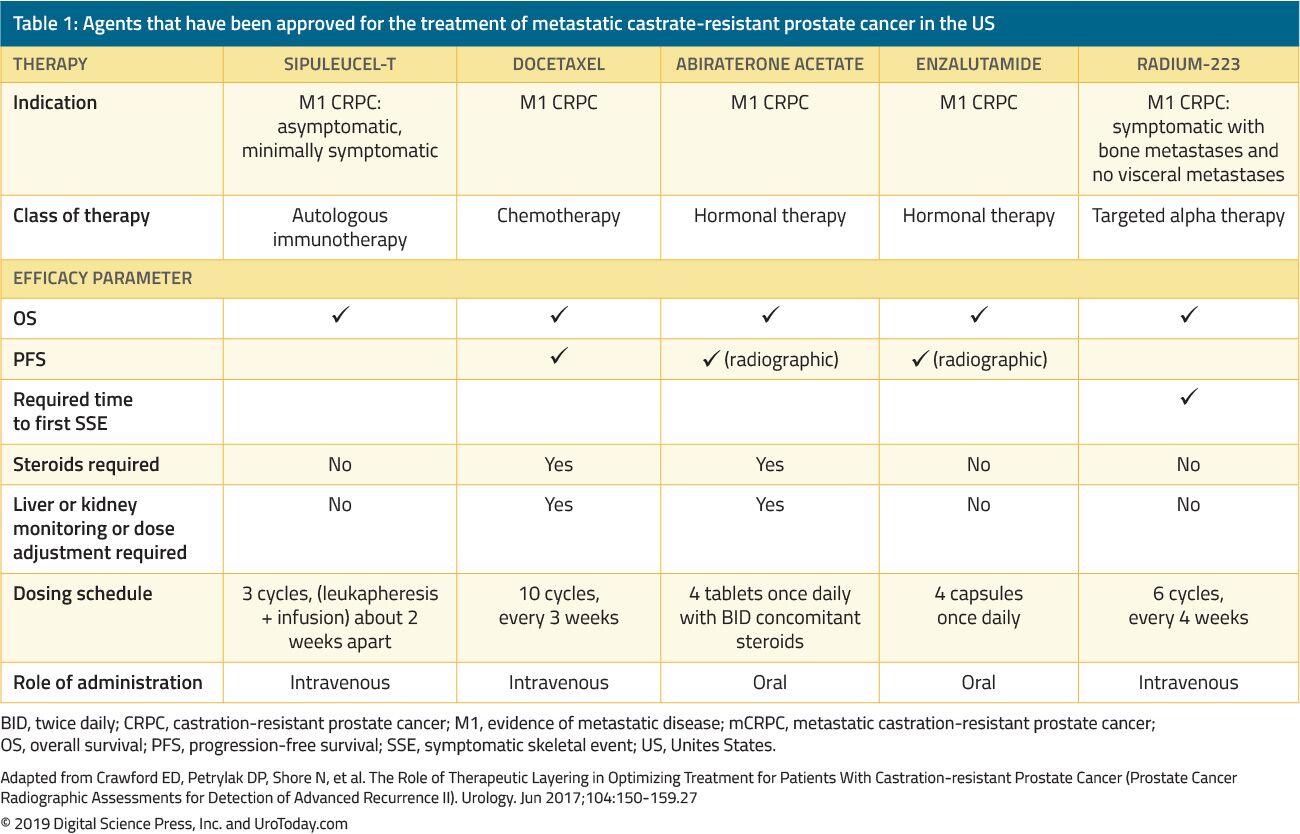
mCRPC 은 일반적으로 쇠약,질병 환자가 대부분에서 혜택을 가능성이 관리 전략을 공식화에 의 종합 팀으로 구성된 비뇨기과,의료 종양 전문의,방사선 종양학,간호사,심리학,사회적 노동자입니다.28 하는 것이 필수적 논의 일시적 완화 처리 옵션을 고려할 때는 추가 조직의 처리를 포함한 관리의 고통,변비,식욕부진,구역질,우울증,피로가 가중됩니다.
이 질병 공간에서 적절한 치료 순서를 확립 할 때 고려해야 할 또 다른 중요한 점은 관련 비용입니다. 를 사용하여 모델이 포함된 추가적인 치료 전 또는 후에 docetaxel,평균 비용 mCRPC 처리하는 동안의 기간을 의미 28.1 개월 동안 약$48,000 당 환자입니다.29 이 비용이 매우 높다는 사실로 인해 환자 받을 수 있는 여러 줄의 치료 및 부과 지속적인 의료 기간 동안 제공하는 서비스의 질환입니다.30
두 번의 시험 만이 두 번째 및 세 번째 라인 치료법을 추가하는 대신 LHRH 유사체에 남아있는 환자의 한계 생존 이점을 입증했습니다.31,32 연구에 따르면 CRPC 는 ADT 에 내성이 없지만 오히려 과민 반응을 보입니다.10Adt 동안 치료 매개 선택 압력으로 인해 ar 이 증폭되고 상황이 확대되지 않도록 MCRPC 설정에서 ADT 를 계속 투여합니다. 치료 매개 선택 압력은 또한 종양의 전체 수명에 걸쳐 계속되어 치료법을 올바르게 서열화 할 필요성을 강화시킵니다. 그러나 전향 적 데이터가 부족하기 때문에 계속 거세의 분 잠재적 이익은 여전히이 치료의 최소한의 위험을 능가합니다. 또한,이후에 승인 된 모든 치료법은 진행중인 ADT 를 가진 남성에서 연구되었으며,계속되어야 할 또 다른 이유가 추가되었습니다.
으로 탐구하기 전에 실제로 사용 가능한 처리 옵션이 있지만,그것은 중요하다는 것을 인식하는것은 아직도 불분명한 경우 치료를 시작에서 mCRPC 환자 완전히 증상이 없어지게 될 것입니다. 이전 치료가 우월한지 또는 환자가 증상이 나타나고 통증이 생길 때까지 기다려야하는지는 아직 알려지지 않았습니다. 치료를 시작하기 전에 환자의 기존 동반 질환과 치료 시작의 예상되는 부작용을 고려해야합니다. 환자와 함께 초기 단계 mCRPC 에 COU-AA-302 평가를 받은 abiraterone 일반적으로 살아남은 거의 일년 동안 사람들보다 더 위약을 받았(평균 OS,53.6 개월 대 41.8 개월,각각,HR,0.61;95%CI,0.43 을 0.87;P=.006).33 따라서,초기 단계의 mCRPC 환자는 abiraterone 의 초기 시작으로부터 혜택을 받았다. 에서 같은 체험을 가진 환자가 증상이나 가벼운 증상 mCRPC,과 기준 PSA<15.6ng/mL abiraterone 도를 더 빠른 속도와의 큰 학위를 PSA 감소를 위약보다.34 현재 이용 가능한 데이터는 제한적이지만,나중에보다는 일찍 치료를 시작하는 것이 더 유리하다는 것을 암시 할 가능성이 큽니다.33,34
승인 첫 번째 라인 치료 옵션을 위한 전이성 거세-저항하는 전립선암
Abiraterone
Abiraterone 는 antiandrogen 는 억제제의 17α-hydroxylase/C17,20-lyase(CYP17)효소입니다. COU-AA-302 상 iii 연구는 내장 전이가없는 1,088 명의 화학 요법 순진,무증상 또는 경미한 증상이있는 mCRPC 환자에서 abiraterone 을 평가했습니다. 이 시험에서 환자는 abiraterone acetate 또는 위약으로 무작위 배정되었으며,둘 다 prednisone35 와 병용되었다(그림 1). 환자는 Ecog(Eastern Cooperative Oncology Group)성능 상태 0 또는 1 과 무증상 또는 경미한 증상이있는 질병에 의해 계층화되었습니다.35OS 와 rpfs(radiographic progression-free survival)는 공동 기본 종점이었습니다. 시험 증명하는 후에는 중간에 따라 수 22.2 개월 동안,거기에 상당한 개선이었다의 rPFS 에 abiraterone arm(평균 16.5 대 8.2 개월,HR0.52,p<0.001). 에 최종 분석 후에는 중간 후속의 49.2 달 OS 에서 끝점으로 크게 긍정적인(34.7 대 30.3 개월,HR:0.81,95%CI:0.70-0.93,p=0.0033).36mCRPC 는 화학 요법이 순진한 경우에도 광범위한 예후 스펙트럼에 걸쳐 있음을 기억하는 것이 중요합니다.37 에서의 분석 abiraterone 의 팔 COU-AA-302 연구,환자의 고통의 기준,정상적인 알칼리인산화효소 및을 알아낼 수,및 10 골전이 있었다 평균 OS 의 42.6 개월입니다.37 그러나 진행에 대한 위험 인자가 더 많은 환자는 중간 OS 가 유의하게 짧았다.37 을 평가할 때 독성의 프로필 abiraterone,그것은 듯 부여 더 이상반응과 관련된 염류 코르티코이드 과잉과 간 기능이 이상이지만,이들은 대부분 등급 1-2 부작용 등이 있습니다. 마지막으로,abiraterone 은 또한 노인 인구(>75 년)에서 똑같이 효과가있는 것으로 나타났습니다.38
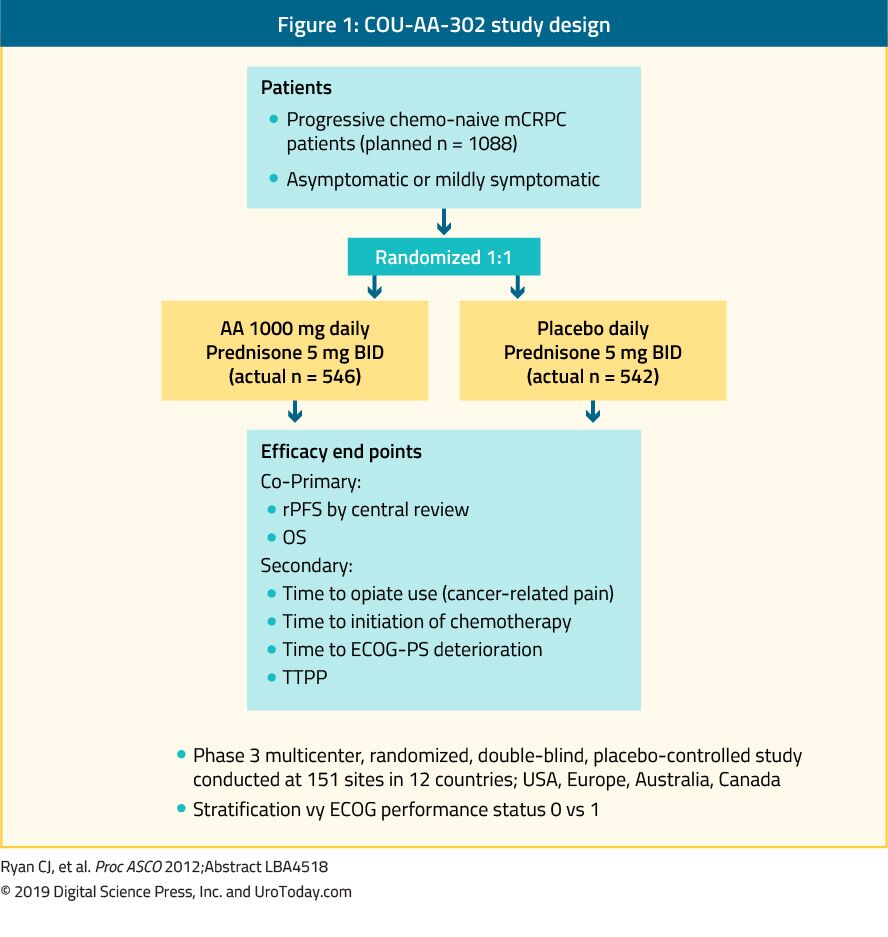
그림 1. COU-AA-302 연구 설계
Enzalutamide
Enzalutamide 는 비 스테로이드 성 항 안드로겐입니다. 의 우선 연구하는 무작위 단계 III 시험 포함되어 있 1,717chemo-naïve mCRPC 환자 및 환자와 전이 내장 받을 수 있었니다.39 이 시험은 엔잘 루타 미드를 위약과 비교했다(그림 2). 은 우선 시험에 상당한 개선을 보여주었 enzalutamide 치료 환자 모두에서 co-primary endpoints,을 포함 rPFS(HR:0.186;CI:0.15-0.23,p<0.0001),OS(HR:0.706;CI:0.6-0.84,p<0.001). 확장 된 후속 조치와 최종 분석은 enzalutamide 에 대한 OS 및 rPFS 의 이점을 확인했습니다.Enzalutamide 로 치료받은 환자의 78%에서 40%이상의 PSA 감소가보고되었습니다. 가장 흔한 임상 적으로 관련된 부작용은 피로와 고혈압이었다. Enzalutamide 는 또한 노인(>75 세)41 과 내장 전이가 있거나없는 사람들에서도 똑같이 효과적이고 내약성이 있었다.42 그러나 간 전이가있는 남성의 경우 식별 할 수있는 이익이없는 것처럼 보였습니다.43 지형 재판은 enzalutamide 를 무작위 이중 맹검 ii 상 연구에서 오래된 항 안드로겐 인 bicalutamide 와 비교하여 pfs 에서 상당한 개선을 보였습니다(15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
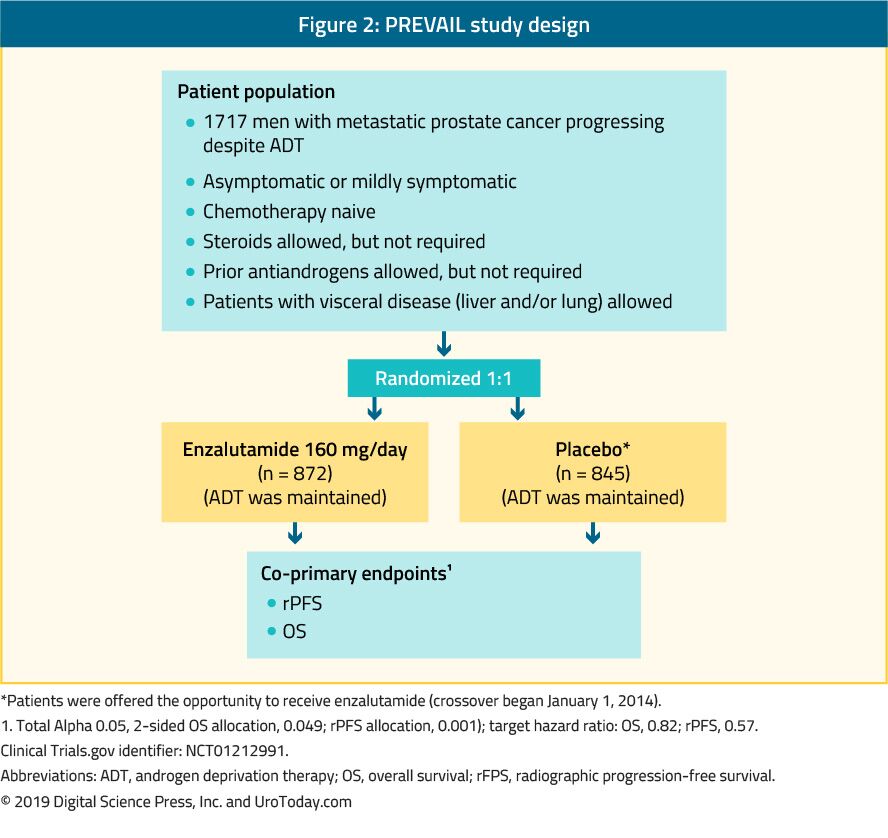
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). 표준 일선 화학 요법은 프레드니손 5mg 을 1 일 2 회,최대 10 주기로 병용 한 3 주간 용량으로 도세탁셀 75mg/m2 입니다. 거기에 몇 가지 중요한 예후 요인을 고려할 때 관리 docetaxel:내 전이,통증,빈혈증(Hb<13g/dL),뼈 검사 진행하고,전 estramustine 치료입니다. 이러한 예후 인자는 도세탁셀에 대한 반응을 계층화하는 데 도움이 될 수 있습니다. 를 사용하여 이러한 예후 요인 질병으로 분류될 수 있습니다 낮은,중간의 그리고 높은 위험과 크게 다른 해당 평균 OS 견적의 25.7,18.7 및 12.8 개월,각각합니다.45 지만 시대에 의해 자체가 금기 docetaxel 치료,환자 맞게해야 충분히 견딜 이 유형의 처리고 comorbidities 평가하기 전에 처리시됩니다. 에서는 남자들이 생각하지 못하는 표준 복용량과 일정 docetaxel,이 감소 될 수 있습에서 75 50mg/m2,모든 이주를 보여주는 더 적은급 3-4 부작용과 시간이 더 치료에 실패입니다.46
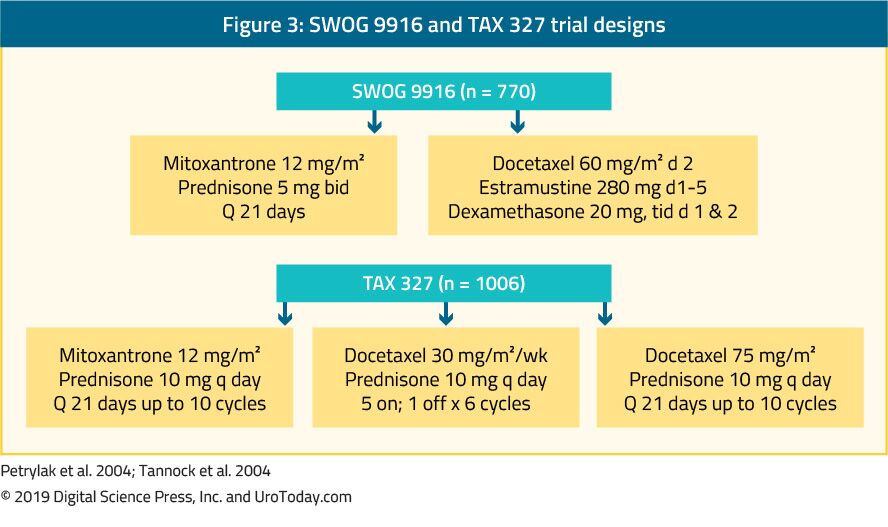
그림 3. SWOG9916 및 세금 327 예심 디자인을
Sipuleucel-T
Sipuleucel-T,헌 활성 세포 면역요법,었에 표시된 단계 III 예심(충격 시험)을 부여 생존에 도움 512 증상이거나 최소한 증상 mCRPC 환자들과 비교했을 때 placebo24(그림 4). 34 개월의 중간 추적 관찰 후,중간 생존율은 sipuleucel-T 군에서 유의하게 높았다(25.8 대 21.7 개월,hr 은 0.78,p=0.03).24 중요하게도,치료 중 또는 치료 후 PSA 감소는 관찰되지 않았고 pfs 는 양팔에서 유사했다. Sipuleucel-T 에 대한 전반적인 내성은 대부분 1-2 등급의 부작용이 발생하여 매우 양호했습니다. 현재이 치료법은 미국에서만 사용할 수 있으며 유럽에서는 더 이상 사용할 수 없습니다.
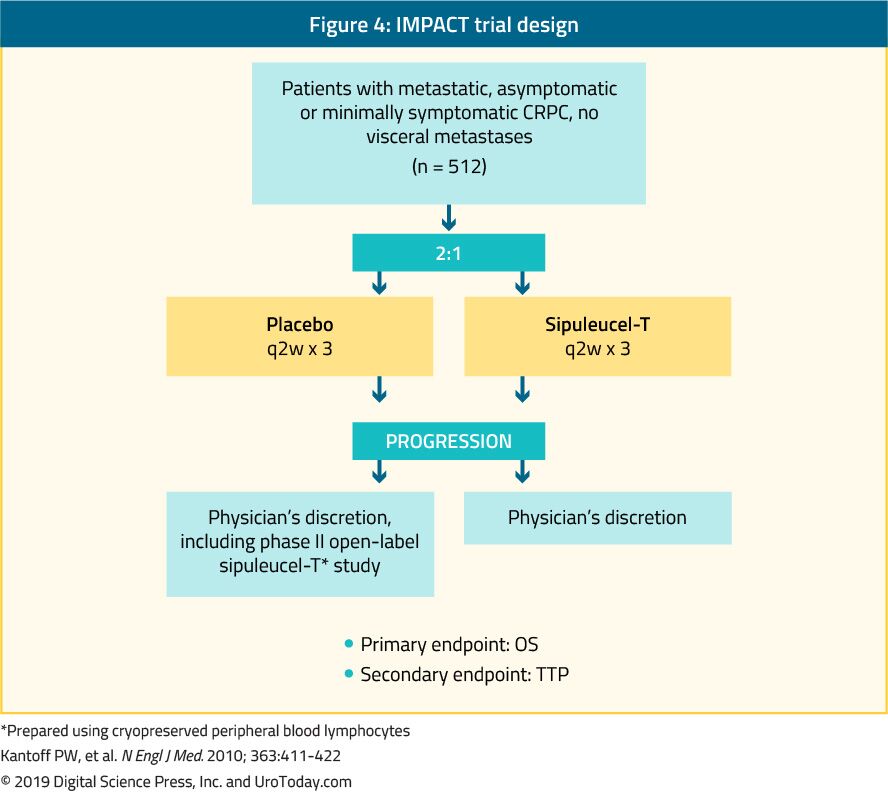
그림 4. IMPACT trial design
결론
지난 15 년 동안 mCRPC 환자의 약물 개발에 상당한 과학적 진보와 투자가있었습니다. 이로 인해 FDA 는 통증 완화,질병 부작용 최소화 및 OS 연장을 이유로 여러 라인의 전신 요법을 승인했습니다. 현재까지 이러한 개별 요원 각각에서 mCRPC 환자의 OS 에 대한보고 된 영향은 여전히 완만하여 불과 몇 개월 만에 추가되었습니다. 그것은 필요한 향상을 우리의 이해 질병의 생물학 mCRPC,통합 포괄적인 분자의 이해 거세성,그리고 분석하는 메커니즘에 저항의 현재 치료하면 향후 치료의 개발. 또한 치료의 개인화를 돕기 위해 예측 바이오 마커를 투자하고 개발하는 것이 중요합니다. 마지막으로,좀 더 실용적이고,더 많은 데이터가 필요에 적합한 두 번째와 세번째 라인 치료,및 시퀀스 조합 및 사용할 수의 약물,에서 자세히 설명한 다른 문서(“저쪽 첫번째 라인 치료의 전이 거세-저항하는 전립선암”).
게시일:2019 년 11 월 19 일
Leave a Reply