생물학 전공자가
학습 결과
- 의 구성 요소를 식별한 간단한 화학반응
모든 요소가 가장 안정적인 때 그들의 가장 바깥쪽 포탄은 가득 전자에 따라 진수 규칙이 있습니다. 이것은 원자가 그 구성에있는 것이 에너지 적으로 유리하기 때문에 안정하게 만듭니다. 그러나,이후 모든 요소가 충분히 전자가 채워 그들의 가장 바깥쪽 껍질,원자 형태의 화학 채권과 다른 원자함으로써 얻은 전자는 그들을 달성하기 위해 필요한 안정적인 전자 구성이 있습니다. 두 개 이상의 원자가 서로 화학적으로 결합 할 때,결과적인 화학 구조는 분자입니다. 익숙한 물 분자,H2O,두 개의 수소 원자와 하나의 산소 원자;이러한 유대를 형성하기 위해 함께 물,그림 1 에 나타낸 바와 같이. 원자는 외부 껍질을 채우기 위해 전자를 기증하거나 수용하거나 공유함으로써 분자를 형성 할 수 있습니다.
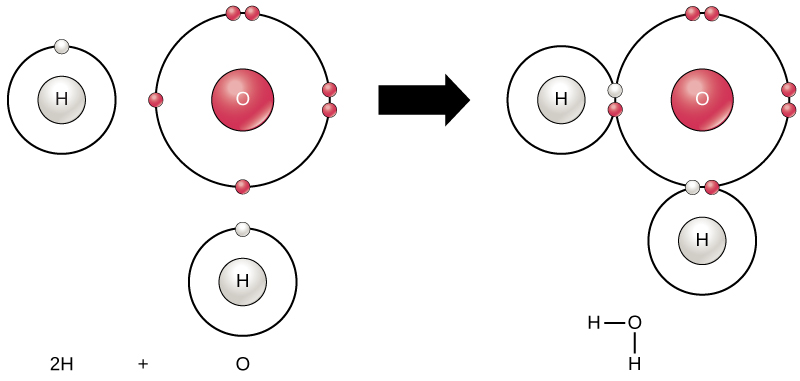
그림 1. 두 개 이상의 원자가 서로 결합되어 분자를 형성 할 수있다. 두 개의 수소와 산소가 공유 결합을 통해 전자를 공유하면 물 분자가 형성됩니다.
화학반응이 발생할 경우 두 개 이상의 원자를 함께 결합 분자를 형성할 때 또는 접착 원자가 깨진다. 물질 사용의 시작 부분에서 화학 반응이라는 반응(일반적으로 발견의 왼쪽에 있는 화학적 방정식),그리고 물질의 반응으로 알려져 있 제품(일반적으로 오른쪽에 발견의 화학 방정식). 화살표 일반적으로 그 사이의 반응물 및 제품의 방향을 표시하는 화학 반응;이러한 경향은 항상”one-way street.”위에 표시된 물 분자의 생성을 위해 화학 방정식은 다음과 같습니다:
2H+O→H2O
의 예는 간단하는 화학 반응이 뜨 과산화수소의 분자로 구성되어 각각의 두 개의 수소 원자를 결합하는 두 개의 산소 원자(H2O2). 반응 과산화수소로 분류된 물을 포함하는,하나의 산소 원자는 바인딩을 두는 수소 원자(H2O),및 산소로 구성되어 두 가지의 결합은 산소 원자(O2). 아래의 방정식에서,반응은 2 개의 과산화수소 분자와 2 개의 물 분자를 포함한다. 이것은 균형 잡힌 화학 방정식의 한 예이며,각 원소의 원자 수는 방정식의 각면에서 동일합니다. 의 법률에 따라 보존의 문제,수의 원자 전후의 화학반응,동일해야 같은 원자,일반적인 상황에서 만들거나 파괴되었다.
2H2O2(과산화수소)→2H2O(물)+O2(산소)
도의 모든 반응물 및 제품의 이 반응은 분자(각 원자 남아있 결합하는 하나 이상의 다른 원자),이 반응에서만 과산화수소 물은 대표자의 서브 클래스의 분자로 알려진 화합물:그들이 원자를 포함 하나 이상의 유형 요소입니다. 반면에 분자 산소는 그림 2 와 같이 두 개의 이중 결합 된 산소 원자로 구성되며 화합물로 분류되지 않고 원소로 분류됩니다.
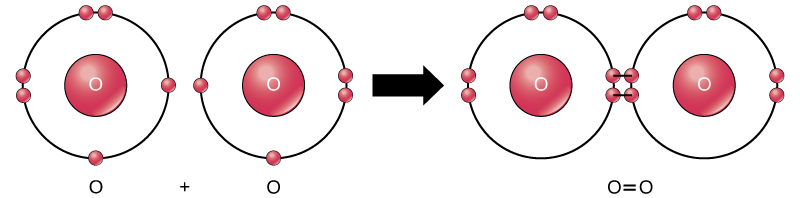
그림 2. O2 분자의 산소 원자는 이중 결합에 의해 결합된다.
일부 화학 반응,다음과 같이,위의를 진행할 수 있습에서 한 방향으로 될 때까지 반응은 모두 사용됩니다. 이러한 반응을 설명하는 방정식은 단방향 화살표를 포함하며 돌이킬 수 없습니다. 가역적 인 반응은 어느 방향 으로든 갈 수있는 반응입니다. 에서 가역 반응,반응은 제품으로 설정하지만,경우 농도의 제품을 넘어 특정 임계 값(특징의 특정 반응),이러한 제품의 일부로 변환됩니다로 다시 반응물;이 지점에서 제품의 명칭 및 반응물은 반대입니다. 이것은 앞뒤로 반응물과 생성물 사이의 특정 상대적 균형—즉 평형이라고하는 상태가 발생할 때까지 계속됩니다. 가역 반응의 이러한 상황은 종종 반응물과 생성물 모두를 가리키는 이중 향하고 화살표가있는 화학 방정식으로 표시됩니다.
예를 들어,인간의 혈액,과도한 수소이온(H+)바인딩을 중탄산이온(HCO3–)형성 평형 상태와 탄산(H2CO3). 탄산이이 시스템에 첨가 되었다면,그 중 일부는 중탄산염과 수소 이온으로 전환 될 것입니다.
HCO3–+H+↔H2CO3
에서 생물학적 반응,그러나,평형을 거의 얻어지기 때문에 농도의 반응 또는 제품이나 모두를 지속적으로 변화하는,종종 제품의 하나는 반응되는 반응이다. 혈액 내의 과량의 수소 이온의 예로 돌아가려면 탄산의 형성이 반응의 주요 방향이 될 것입니다. 그러나,탄산을 남길 수 있습 몸으로 이산화탄소 가스(을 통해 호기)대신으로 다시 변환하여 중탄산이온,따라서 운전 반응하는 오른쪽으로는 화학적으로 알려진 법률 법률의 대량 작업입니다. 이러한 반응은 우리 혈액의 항상성을 유지하는 데 중요합니다.
HCO3–+H+↔H2CO3↔CO2+H2O
요약하면: 화학적 반응과 분자
외부 전자 껍질이 지시하는 방법을 쉽게 그리고 어떤 유형의 화학 채권은 특정한 원자이 형성됩니다. 의 형성 화합물은 종종 시각적으로 설명에서 화학 방정식을 보여주는 반응에 참여하는 화학 반응하는 형태로 제품입니다.나는 그것을 시도 할 수 없다.
이 페이지를 개선하십시오.
Leave a Reply