Kemisk binding
kemiske bindinger er attraktionerne mellem atomer, der holder dem sammen for at danne forbindelser. Der er tre hovedtyper af binding: kovalente bindinger, der binder sammen molekylære forbindelser, ioniske bindinger, der binder salte og Ioniske krystaller, og metalliske bindinger, der binder atomer af metaller.
molekyler og kovalente bindinger
de fleste brændstoffer, plast og naturlige produkter er molekylære forbindelser, lavet af atomer bundet sammen til molekyler. Typen af binding, der forbinder atomerne i et molekyle, er kovalent binding, som opstår, når de ydre elektroner af to atomer deles mellem dem, hvilket skaber en tiltrækning mellem de to atomer.
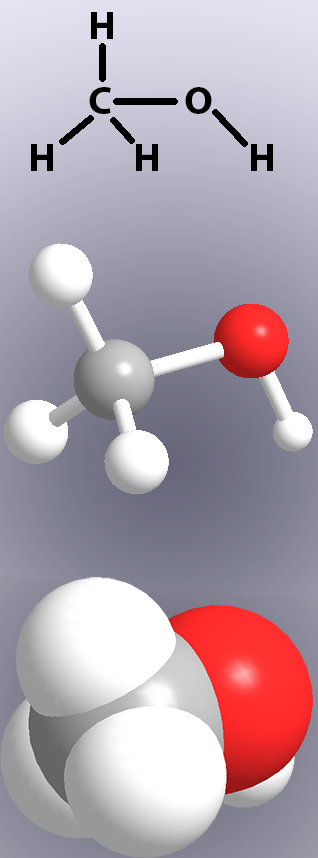
kovalente bindinger vises i kemiske strukturer med linjer (Figur 1, øverst) og i Modeller ved enten at vise ‘pinde’ eller overlapningen af atomerne (Figur 1, mellem og bund). elektronerne i en kovalent binding deles ikke altid ligeligt mellem de to atomer. Når delingen er ulige, vil et atom have en meget lille positiv ladning, og det andet atom vil være lidt negativt. Dette kasser en lille elektrisk dipol-molekyler, der indeholder en dipol er polære forbindelser. Hvorvidt et molekyle er polært eller ikke-polært vil påvirke dets egenskaber, såsom smelte-og kogepunkter og hydrogenbinding.
Læs mere om kovalent binding på kemi-Libreteksten.
ionisk og metallisk binding
mens kovalent binding involverer deling af elektroner mellem to atomer, involverer ionbinding fuldstændig overførsel af elektroner fra et atom til et andet, hvilket skaber positive og negative ioner. Disse ioner holdes derefter sammen af tiltrækningen mellem deres modsatte ladninger. Ioniske forbindelser danner krystaller baseret på disse attraktioner.
metallisk binding involverer fuldstændig deling af valenselektronerne af metalatomer, hvilket skaber et “elektronhav”, hvor elektroner er fri til at bevæge sig. Dette er en del af årsagen til metallernes høje ledningsevne. Læs mere om metallisk binding på kemi Libretekst
energi og kemiske bindinger
generelt frigives energi, når der dannes en binding mellem to atomer, uanset hvilken type binding. Tilsvarende, hvis der allerede findes en binding mellem to atomer, kræves der energi for at bryde den. Den mængde energi, der kræves for at bryde en binding, er den samme som den mængde energi, der frigives, når den dannes.
de fleste kemiske reaktioner involverer både brud og fremstilling af kemiske bindinger. Hvis den energi, der frigives ved at danne nye bindinger, er større end den energi, der er nødvendig for at bryde de “gamle” bindinger, frigives energi generelt ved reaktionen. Denne energi kan gå tabt som varme eller kan bruges til strøm.
for eksempel følger forbrændingen af methan (CH4) denne kemiske reaktion:
denne reaktion involverer brud på de fire carbon-hydrogenbindinger i methan og ilt-iltbindingen i O2. Nye dannede bindinger er de to kulstof-iltbindinger (i CO2) og brint-iltbindinger (i H2O). Disse nye obligationer har generelt mindre energi end de oprindelige obligationer, så energi frigives ved denne reaktion. Frigivelse af energi er et kendetegn ved forbrændingsreaktioner – du har måske bemærket dette, når du føler en varm flamme. Animationen nedenfor illustrerer kulbrinteforbrændingen af methan.
da en stor mængde energi frigives, når der dannes CO2 og H2O ved forbrænding af kulbrinter som methan, er disse en god primær energikilde. Det betyder også, at en stor mængde energi ville være nødvendig for at bryde bindingerne i CO2 og danne andre molekyler. Dette er en af grundene til, at fotosyntese kræver så meget energi (fra sollys) for at omdanne CO2 til kulhydrater.
for yderligere læsning
- kemisk energi
- forbrænding
- primær energi
- energikonverteringsteknologi
- eller Udforsk en tilfældig side
Leave a Reply