Kemi: Hvad er syrer og baser?
Hvad er syrer og baser?
selvom jeg har fortalt dig, at syrer og baser ikke er svære at forstå, har jeg dårlige nyheder: der er ikke en, men tre almindelige definitioner, der bruges til at beskrive syrer og baser: Arrhenius syrer og baser, Brnsted-lavry syrer og baser og Levis syrer og baser. Selvom dette får det til at lyde som om du bliver nødt til at lære om syrer og baser tre gange, er den gode nyhed, at disse tre definitioner til mange praktiske formål er omtrent ens.
Arrhenius syrer og baser
langt tilbage i slutningen af 1800 ‘ erne kom vores gamle ven Svante Arrhenius med definitioner af syrer og baser, mens vi arbejdede med kinetikproblemer.ifølge Arrhenius er syrer forbindelser, der bryder op i vand for at afgive hydronium (H+) ioner. Et almindeligt eksempel på en Arrhenius syre er saltsyre (HCl):
- HCl ? H + + Cl-
formlerne for syrer starter normalt med hydrogen, selvom organiske syrer er en bemærkelsesværdig undtagelse. Navne og formler for nogle almindelige syrer er angivet i nedenstående tabel:
| syre navn | formel |
|---|---|
| saltsyre | HCl |
| salpetersyre | HNO3 |
| phosphorsyre | H3PO4 |
| svovlsyre | H2SO4 |
| eddikesyre | c2h4o2 |
- NaOH ? Na + + OH-
baser har typisk ” OH ” i deres formler, selvom der er undtagelser. For eksempel indeholder ammoniak (NH3) ikke hydroksidioner, men danner dem, når det reagerer med vand:
- NH3 + H2O ? NH4 + + OH-
navne og formler for nogle fælles baser findes i følgende tabel:
| Basisnavn | formel | |
|---|---|---|
| ammoniak | NH3 | |
| KOH | ||
| natriumbicarbonat | NaHCO3 | |
| natriumcarbonat | Na2CO3 | |
| NaOH |
baser, når der tilsættes vand. Fordi disse forbindelser ikke indeholder nogen H + eller OH – ioner, medmindre de reagerer med vand, kaldes de “anhydrider.”Typisk er ikke-metaller syreanhydrider (de danner syre, når de placeres i vand), og metaller er baseanhydrider (danner en base, når de placeres i vand).i begyndelsen af 1900 ‘ erne blev en alternativ definition for syrer og baser foreslået af Johannes Brnsted og Thomas Lavry for at redegøre for, at ammoniak kan neutralisere surhedsgraden af HCl, selvom vand ikke er til stede. Dette fænomen viste dem, at ammoniak er en base, selv når der ikke er vand rundt for at danne hydroksidioner.
der er mange forskellige navne og formler, der bruges til at beskrive hydronionionen. Selvom formlen tidligere blev vist som” H+”, skrives den undertiden som” H3O”, fordi dette er den ion, der dannes, når H+ kombineres med vand. En anden almindelig måde at henvise til hydroniumioner er bare at kalde dem “protoner.”Dette navn kommer fra det faktum, at H+ repræsenterer et hydrogenatom (en proton og en elektron), der har mistet sin elektron og kun efterlader den blotte proton.
en Brnsted – lavsyre er defineret som en forbindelse, der giver hydroniumioner til en anden forbindelse?for eksempel giver saltsyre H+ ioner til forbindelser, den reagerer med. Brnsted-lavry baser er forbindelser, der kan acceptere hydroniumioner?når ammoniak får en hydroniumion fra HCI, danner den ammoniumionen.
følgende ligning repræsenterer reaktionen af en Brnsted – lavsyre med en Brnsted-Lavry base:
- HNO3 + NH3 ? NO3 – + NH4 +
i denne reaktion opfører salpetersyre sig som en syre, fordi den giver en proton til ammoniak. Ammoniak opfører sig som en base, fordi den accepterer protonen fra salpetersyre.men hvis du kigger på den anden side af ligningen, finder vi nitrat-og ammoniumionerne. Fordi nitrationen kan acceptere protoner fra ammoniumionen (til dannelse af HNO3), er nitrationen en meget svag brnsted-Lavry base. Fordi ammoniumionen har en ekstra proton at donere (i dette tilfælde til nitrationen), er det en Brnsted-Lavry syre.nitritet er baseret på salpetersyremolekylet, så vi siger, at det er den konjugerede base af salpetersyre. Ligeledes er ammoniumionen konjugatsyren af ammoniak. Sammen betegnes en syre med dens konjugerede base (såsom HNO3 og NO3-) eller en base med dens konjugerede syre (såsom NH3 og NH4+) som et konjugeret syre-basepar.
Levis syrer og baser
i brnsted-Lavry definitionen af syrer og baser defineres en base som en forbindelse, der kan acceptere en proton. Men hvordan accepterer den protonen?en funktion, som brnsted-Lavry baser har til fælles med hinanden, er, at de har et ikke-delt par elektroner. Når en hydroniumion kommer vandrende af molekylet, vil de ensomme par undertiden nå ud og gribe det. Et eksempel på dette er, når ammoniak accepterer en proton i en sur opløsning:
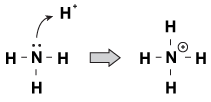
figur 23.1 ammoniak kan få fat i en proton fra salpetersyre med sit ensomme par elektroner.
en måde at se på denne proces er, at ammoniakatomet donerer sit ensomme par til protonen. Fordi de ensomme par kører denne kemiske reaktion, har vi en ny definition af surhed og basicitet, kaldet “Levis surhed/basicitet.”En base er en forbindelse, der donerer et elektronpar til en anden forbindelse (ammoniak i vores eksempel). En syre er en forbindelse, der accepterer et elektronpar (H + ion i vores eksempel).
Livis baser er kemikalier, der kan donere elektronpar. Levis syrer er kemikalier, der kan acceptere dem.selvom vi havde ammoniak, der donerede et ensomt par til en proton i vores eksempel, kan det ensomme par i ammoniak også reagere med mange andre forbindelser. For eksempel kan ammoniak donere sit ensomme par elektroner til BH3 ved følgende proces:

figur 23.2 det ensomme par på ammoniak, der fastgør sig til BH3.
i denne proces er ammoniak basen, og BH3 er syren.
generelt er definitionen af syrer og baser den mest nyttige, fordi den er den mest inkluderende af de tre definitioner. For eksempel omfatter brnsted-Lavry definitionen af en syre HF, men ikke BH3, som ikke mister en proton, når den fastgøres af de ensomme par på en uvis base.uddrag fra The Complete Idiot ‘ s Guide to Chemistry 2003 af Ian Guch. Alle rettigheder forbeholdes, herunder retten til reproduktion helt eller delvist i enhver form. Anvendes efter aftale med Alpha Books, medlem af Penguin Group (USA) Inc.
for at bestille denne bog direkte fra udgiveren, besøg Penguin USA hjemmeside eller ring 1-800-253-6476. Du kan også købe denne bog på Amazon.com og Barnes & ædel.
Leave a Reply