Trattamento di prima linea per il cancro alla prostata metastatico resistente ai castrati
Nel 2019 il cancro alla prostata (PCa) rappresenta quasi 1 su 5 nuove diagnosi di cancro negli uomini negli Stati Uniti.1 Negli ultimi anni il tasso complessivo di incidenza del cancro alla prostata (PCa) è diminuito di circa il 7% all’anno.1 Il forte calo dell’incidenza è stato comunemente attribuito alla diminuzione dei test dell’antigene prostatico specifico (PSA) dal 2008 al 2013. La diminuzione dell’uso dello screening del PSA è stata causata dalle raccomandazioni della Task Force dei servizi preventivi degli Stati Uniti (USA) contro lo screening di routine del PSA. Questa era una raccomandazione di grado D specificamente negli uomini di età pari o superiore a 75 anni, dichiarata nel 2008 e successivamente estesa a tutti gli uomini nel 2011, a causa delle crescenti preoccupazioni di sovradiagnosi e sovratrattamento.2 Sebbene la prevalenza dei test del PSA abbia smesso di diminuire e si sia stabilizzata da 2013 a 2015,3 l’effetto della riduzione dello screening sull’incidenza della malattia avanzata non è ancora chiaro. Un’analisi di un ampio registro dei tumori che copre l ‘ 89% della popolazione statunitense ha riferito che il calo complessivo dell’incidenza di PCa sta, infatti, mascherando un aumento delle diagnosi a distanza dal 2010 tra età e razza.4
Indipendentemente dal trattamento, circa il 20% -30% dei pazienti con PCa localizzata progredisce verso la malattia metastatica, comunemente trattata con terapia ormonale.5 Ciò può essere data con la castrazione chirurgica (orchiectomy bilaterale) o con la castrazione medica facendo uso della terapia di privazione dell’androgeno (ADT). Entrambi i metodi raggiungono un livello di castrato di testosterone sierico che è considerato come lo standard di cura per il trattamento metastatico ormone-sensibile PCa (mHSPC). Tuttavia, mHSPC è destinato a progredire verso il carcinoma prostatico metastatico resistente ai castrati (mCRPC).6 Lo stato del cancro alla prostata resistente ai castrati (CRPC) è definito come progressione della malattia nonostante il raggiungimento dei livelli di testosterone castrato (testosterone sierico < 50 ng/dL o 1.7 nmol / L), e può presentarsi come un continuo aumento dei livelli sierici di PSA, progressione della malattia preesistente e / o comparsa di nuove metastasi.7 La CRPC ha una sopravvivenza mediana di circa tre anni8 ed è associata ad un significativo deterioramento della qualità della vita.9 L’esatto meccanismo di transizione da mHSPC a mCRPC non è ancora chiaro. Tuttavia, è noto che nonostante i livelli di castrato di androgeni, il recettore degli androgeni (AR) rimane attivo e continua a guidare la progressione PCa in CRPC.10 Ciò ha portato allo sviluppo di nuovi agenti volti a ridurre ulteriormente la produzione di androgeni o bloccare la funzione AR. Tuttavia, ci sono altre vie biologiche che funzionano indipendentemente dalla segnalazione degli androgeni e provocano anche CRPC.
Alcuni significativi cambiamenti avvenuti nella opzioni di trattamento del mHSPC spazio con conseguente notevole beneficio in termini di sopravvivenza (si prega di vedere “L’evoluzione rapida strategia di gestione del metastatico ormono-Sensibile Cancro alla Prostata” link), tra cui l’introduzione della chemioterapia nel CHAARTED study11 e STAMPEDE prova,12 l’aggiunta di abiraterone acetato e prednisone in LATITUDINE study13 e STAMPEDE prova,14 l’aggiunta di enzalutamide in ARCHI trial15 e il ENZAMET di studio,16 e, infine, l’aggiunta di apalutamide, un orale di farmaci anti-androgeni, che, come enzalutamide, lega direttamente al dominio legante del legante dell’AR ed impedisce la traslocazione dell’AR, il legame del DNA e la trascrizione AR-mediata.Lo studio TITAN ha mostrato un beneficio di sopravvivenza globale (OS) nei pazienti mHSPC trattati con apalutamide.18 Apalutamide ha anche mostrato un beneficio rispetto al placebo nell’impostazione CRPC non metastatica (nmCRP) nello studio SPARTAN di fase 3 controllato con placebo,19 simile al beneficio mostrato dai pazienti trattati con enzalutamide nonmetastatic castrate-resistant prostate cancer (nmCRPC), nello studio PROSPER20 (vedere il link “The novel treatments for the non-metastatic castrate-resistant prostate cancer”). Questi progressi di trattamento nell’impostazione mHSPC e nmCRPC hanno sollevato la questione di quali opzioni di trattamento dovrebbero essere offerte ai pazienti nell’impostazione mCRPC.21
Il trattamento degli uomini con CRPC è radicalmente cambiato negli ultimi 15 anni. Prima del 2004, quando i pazienti hanno fallito la ADT primaria, i trattamenti sono stati somministrati esclusivamente per la palliazione. Le prove di riferimento di Tannock et al.22 e Petrylak et al.23 nel 2004 sono stati i primi a introdurre la chemioterapia docetaxel in pazienti con mCRPC che hanno dimostrato di migliorare la loro sopravvivenza. Tuttavia, dal momento che docetaxel è stato approvato dalla FDA, cinque ulteriori agenti benefici che mostrano un vantaggio di sopravvivenza sono stati approvati dalla FDA sulla base di studi clinici randomizzati (Tabella 1). Questi includono enzalutamide e abiraterone, che influenzano specificamente l’asse degli androgeni, sipuleucel-T, che stimola il sistema immunitario;24 cabazitaxel, che è un altro agente chemioterapico;25 e radium-223, una terapia con radionuclidi.26 Altri trattamenti per mCRPC hanno dimostrato di migliorare i risultati, ma sono ancora stati approvati dalla FDA e saranno discussi in un’altra recensione. A causa del sostanziale aumento di più agenti terapeutici approvati dalla FDA nei pazienti con CRPC, i medici sono sfidati con una pletora di opzioni di trattamento e numerose sequenze potenziali di questi agenti, rendendo il processo decisionale clinico in mCRPC significativamente più complesso.
Tabella 1. Gli agenti che sono stati approvati per il trattamento delle metastasi castrare-resistente al cancro alla prostata negli USA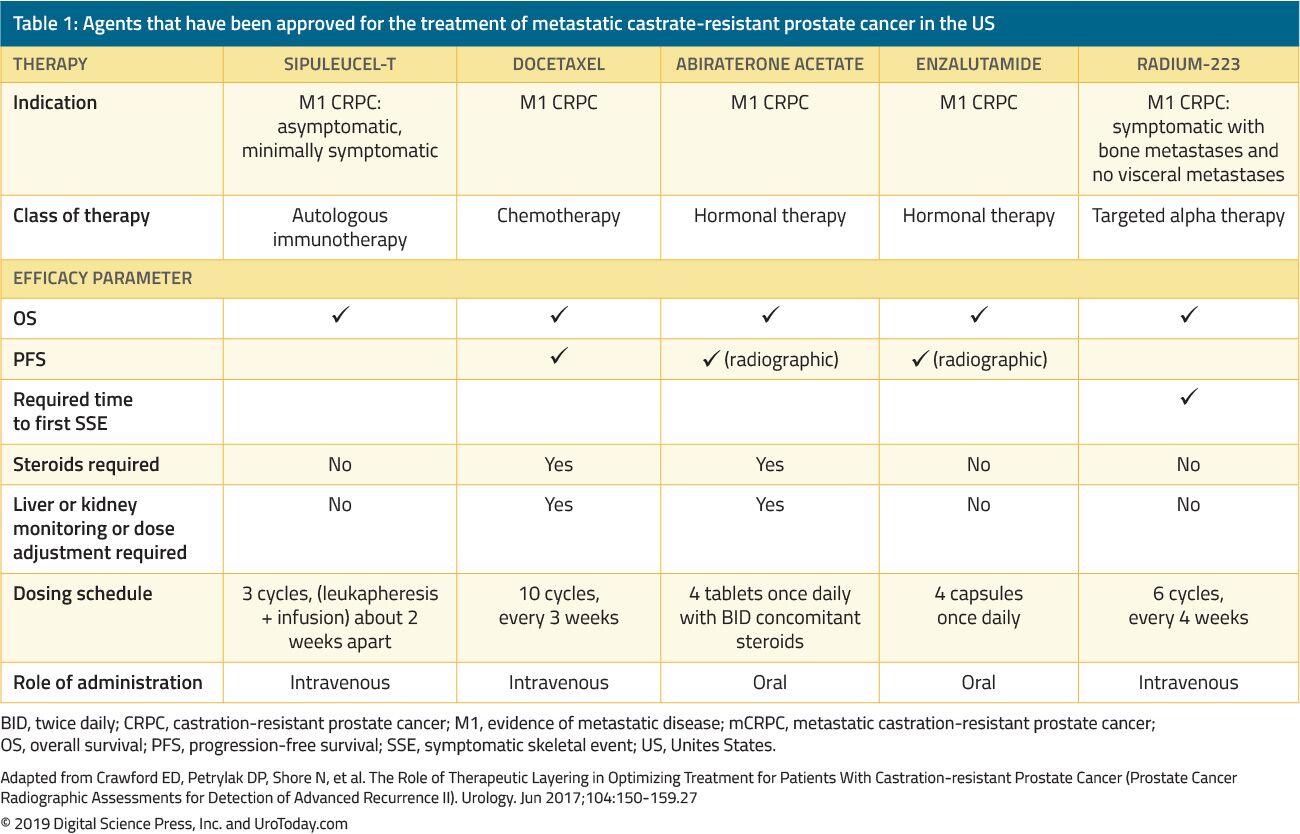
mCRPC è di solito una malattia debilitante, e i pazienti più beneficeranno di una strategia di gestione formalizzato da un team multidisciplinare composto di urologi, oncologi medici, oncologi di radiazione, infermieri, psicologi e assistenti sociali.28 È imperativo discutere le opzioni di trattamento della palliazione quando si considera un trattamento sistemico aggiuntivo, inclusa la gestione del dolore, costipazione, anoressia, nausea, depressione e affaticamento.
Un altro punto cruciale da considerare quando si stabilisce la sequenza di trattamento appropriata in questo spazio di malattia è il costo associato. Utilizzando modelli che includevano linee di trattamento aggiuntive prima o dopo docetaxel, il costo medio del trattamento con mCRPC durante un periodo medio di 28,1 mesi è stato di circa $48.000 per paziente.29 Questo costo è piuttosto elevato a causa del fatto che i pazienti possono ricevere più linee di terapia e sostenere servizi medici in corso durante il corso della loro malattia.30
Solo due studi hanno dimostrato un beneficio marginale di sopravvivenza per i pazienti che rimangono con analoghi LHRH invece di aggiungere terapie di seconda e terza linea.31, 32 Studi hanno dimostrato che il CRPC non è resistente all’ADT, ma piuttosto ipersensibile ad esso.10 La pressione di selezione mediata dal trattamento durante l’ADT fa sì che l’AR si amplifichi e assicuri che la situazione non degeneri, l’ADT viene continuato ad essere somministrato nell’impostazione mCRPC. La pressione di selezione mediata dal trattamento continua anche per tutta la durata del tumore, intensificando la necessità di sequenziare correttamente le terapie. Tuttavia, poiché mancano dati prospettici, il beneficio potenziale minimo di continuare la castrazione supera ancora il rischio minimo di questo trattamento. Inoltre, tutti i trattamenti successivamente approvati sono stati studiati negli uomini con ADT in corso, aggiungendo un altro motivo per cui dovrebbe essere continuato.
Prima di approfondire le effettive opzioni di trattamento disponibili, è importante riconoscere che non è ancora chiaro quando iniziare la terapia nei pazienti con mCRPC che sono completamente asintomatici. Non è ancora noto se il trattamento precedente sia superiore o se dovremmo aspettare che il paziente diventi sintomatico e sviluppi dolore. Prima di iniziare il trattamento, dovremmo considerare le comorbidità esistenti del paziente e gli effetti avversi attesi dall’inizio della terapia. I pazienti con mCRPC in fase iniziale nello studio COU-AA-302 che hanno ricevuto abiraterone sono sopravvissuti in genere quasi un anno in più rispetto a quelli che hanno ricevuto placebo (OS mediana, 53,6 mesi vs. 41,8 mesi, rispettivamente, HR, 0,61; IC al 95%, da 0,43 a 0,87; P = .006).Pertanto, i pazienti con mCRPC in fase iniziale hanno beneficiato di un inizio precoce di abiraterone. Nello stesso studio i pazienti con mCRPC asintomatica o lievemente sintomatica, con PSA al basale < 15,6 ng/mL abiraterone hanno anche portato ad un tasso più rapido e ad un maggior grado di declino del PSA rispetto al placebo.34 Sebbene i dati attualmente disponibili siano limitati, molto probabilmente suggerisce che iniziare il trattamento prima piuttosto che dopo sia più vantaggioso.33,34
Approvato opzioni di trattamento di prima linea per metastatico castrato-resistente cancro alla prostata
Abiraterone
Abiraterone è un antiandrogeno che è un inibitore di 17α-idrossilasi/C17, 20-liasi (CYP17) enzima. Lo studio di fase III COU-AA-302 ha valutato abiraterone in 1.088 pazienti con mCRPC chemio-naïve, asintomatici o lievemente sintomatici senza metastasi viscerali. In questo studio i pazienti sono stati randomizzati ad abiraterone acetato o placebo, entrambi combinati con prednisone35 (Figura 1). I pazienti sono stati stratificati dal performance status 0 o 1 dell’Eastern Cooperative Oncology Group (ECOG) e dalla malattia asintomatica o lievemente sintomatica.35 OS e radiographic Progression-free survival (rPFS) erano gli end-point co-primari. Lo studio ha dimostrato che dopo un follow-up mediano di 22,2 mesi, si è verificato un miglioramento significativo dell’rPFS nel braccio con abiraterone (mediana 16,5 vs. 8,2 mesi, HR 0,52, p < 0,001). All’analisi finale dopo un follow-up mediano di 49,2 mesi, l’end-point OS è risultato significativamente positivo (34,7 vs. 30,3 mesi, HR: 0,81, IC al 95%: 0,70-0,93, p = 0,0033).36 È importante ricordare che la mCRPC copre un ampio spettro prognostico anche quando è naïve alla chemioterapia.In un’analisi del braccio abiraterone dello studio COU-AA-302, i pazienti che non avevano dolore al basale, livelli normali di fosfatasi alcalina e LDH e meno di 10 metastasi ossee avevano una OS mediana di 42,6 mesi.Tuttavia, i pazienti con più fattori di rischio per la progressione avevano una OS mediana significativamente più breve.37 Nel valutare il profilo di tossicità di abiraterone, è sembrato conferire più eventi avversi correlati all’eccesso di mineralcorticoidi e alle anomalie della funzionalità epatica, ma questi erano per lo più classificati 1-2 effetti avversi. Infine, abiraterone si è dimostrato ugualmente efficace anche nella popolazione anziana (> 75 anni).38
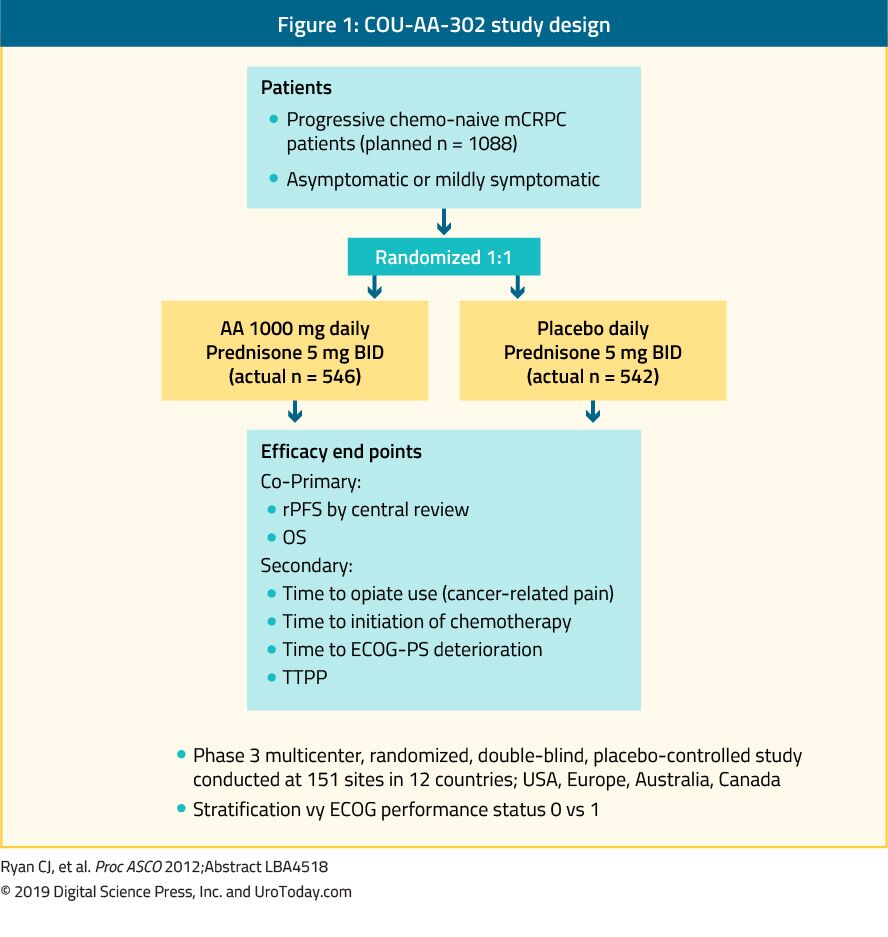
Figura 1. COU-AA-302 studio design
Enzalutamide
Enzalutamide è un antiandrogeno non steroideo. Lo studio PREVAIL, che è uno studio randomizzato di fase III, ha incluso 1.717 pazienti con mCRPC naïve alla chemioterapia e anche i pazienti con metastasi viscerali erano eleggibili.Questo studio ha confrontato enzalutamide con placebo (Figura 2). Lo studio PREVAIL ha mostrato un miglioramento significativo nei pazienti trattati con enzalutamide in entrambi gli endpoint co-primari, che includevano rPFS (HR: 0,186; IC: 0,15-0,23, p < 0,0001) e OS (HR: 0,706; IC: 0,6-0,84, p < 0,001). Il follow-up esteso e l’analisi finale hanno confermato un beneficio in OS e rPFS per enzalutamide.40 Nel 78% dei pazienti trattati con enzalutamide è stata riportata una diminuzione del PSA superiore al 50%. Gli eventi avversi clinicamente rilevanti più comuni sono stati affaticamento e ipertensione. Enzalutamide è risultata ugualmente efficace e ben tollerata anche negli uomini anziani (> 75 anni)41 e in quelli con o senza metastasi viscerali.42 Tuttavia, per gli uomini con metastasi epatiche, non sembrava esserci alcun beneficio distinguibile.43 Lo studio TERRAIN ha confrontato enzalutamide con bicalutamide, un antiandrogeno più vecchio, in uno studio randomizzato in doppio cieco di fase II, mostrando un miglioramento significativo nella PFS (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
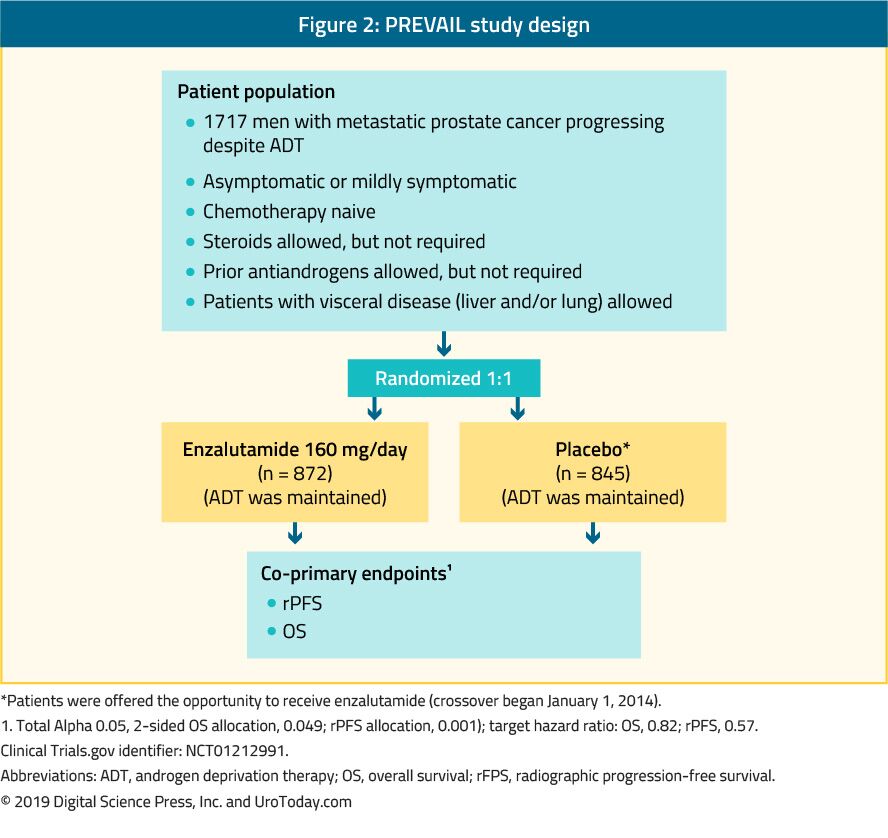
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). La chemioterapia standard di prima linea è docetaxel 75 mg / m2 in dosi di tre settimane combinate con prednisone 5 mg due volte al giorno, fino a dieci cicli. Ci sono diversi fattori prognostici importanti da considerare quando si somministra docetaxel: metastasi viscerali, dolore, anemia (Hb < 13 g/dL), progressione della scansione ossea e precedente terapia con estramustina. Questi fattori prognostici possono aiutare a stratificare la risposta a docetaxel. Utilizzando questi fattori prognostici la malattia può essere classificata in basso, intermedio e ad alto rischio, con significativamente diverse corrispondenti stime OS mediana di 25.7, 18,7 e 12,8 mesi, rispettivamente.Sebbene l ‘età di per sé non costituisca una controindicazione alla terapia con docetaxel, i pazienti devono essere sufficientemente in grado di sopportare questo tipo di trattamento e le comorbidità devono essere valutate prima dell’ inizio del trattamento. Negli uomini che si ritiene non siano in grado di tollerare la dose standard e lo schema di somministrazione di docetaxel, questo può essere ridotto da 75 a 50 mg/m2 ogni due settimane, mostrando meno eventi avversi di grado 3-4 e un tempo più lungo per il fallimento del trattamento.46
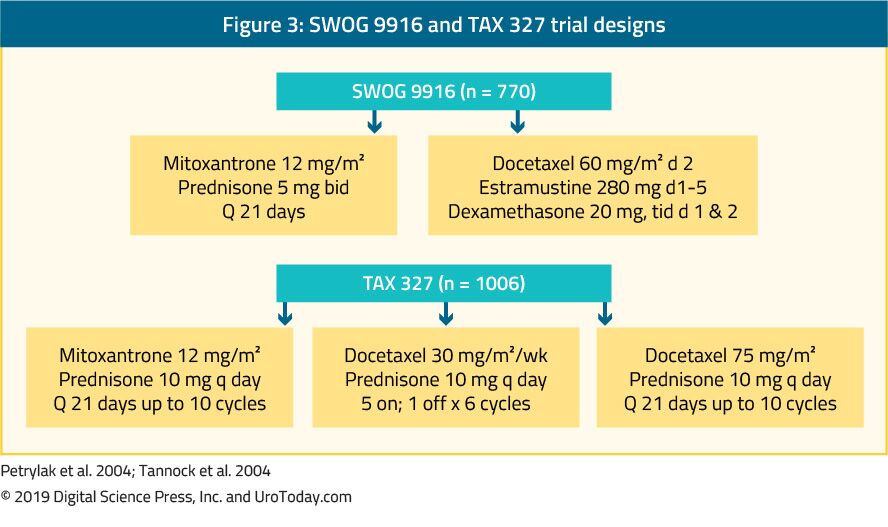
Figura 3. Progetti di studio SWOG 9916 e TAX 327
Sipuleucel-T
Sipuleucel-T, un’immunoterapia cellulare attiva autologa, è stato dimostrato in uno studio di fase III (studio IMPACT) di conferire un beneficio di sopravvivenza in 512 pazienti mCRPC asintomatici o minimamente sintomatici rispetto a placebo24 (Figura 4). Dopo un follow-up mediano di 34 mesi, la sopravvivenza mediana è stata significativamente più alta nel gruppo sipuleucel-T (25,8 vs. 21,7 mesi, con una HR di 0,78,p = 0,03).È importante sottolineare che non è stata osservata alcuna diminuzione del PSA durante o dopo il trattamento e che la PFS era simile in entrambi i bracci. La tolleranza complessiva a sipuleucel-T è stata molto buona, con eventi avversi per lo più di grado 1-2. Attualmente, questo trattamento è disponibile solo negli Stati Uniti e non è più disponibile in Europa.
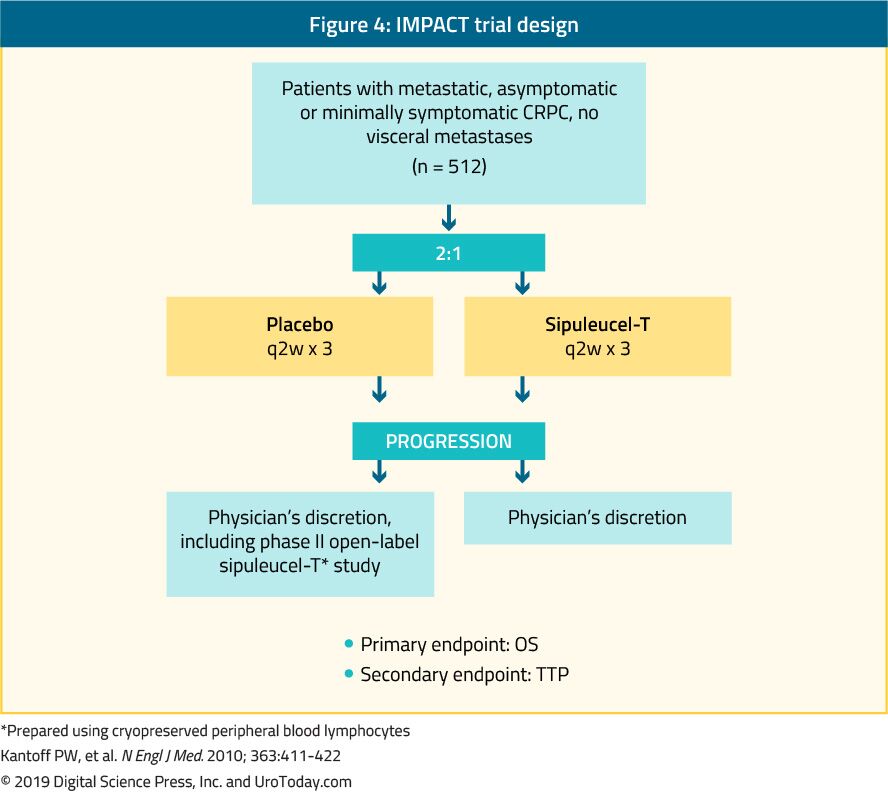
Figura 4. IMPACT trial design
Conclusioni
Negli ultimi 15 anni, ci sono stati notevoli progressi scientifici e investimenti nello sviluppo di farmaci per i pazienti con mCRPC. Ciò ha portato all’approvazione della FDA di diverse linee di terapie sistemiche per motivi di palliazione del dolore, riducendo al minimo gli effetti avversi della malattia e il prolungamento del sistema operativo. Ad oggi, l’impatto riportato sulla OS nei pazienti mCRPC da ciascuno di questi singoli agenti è ancora modesto, con conseguente aggiunta di pochi mesi. È necessario migliorare la nostra comprensione della biologia della malattia di mCRPC, integrare una comprensione molecolare completa della resistenza alla castrazione e analizzare i meccanismi di resistenza alle terapie attuali per migliorare lo sviluppo futuro del trattamento. È anche fondamentale investire e sviluppare biomarcatori predittivi per aiutare nella personalizzazione della terapia. Infine, su una nota più pratica, sono necessari più dati sulle terapie appropriate di seconda e terza linea e sul sequenziamento e sulla combinazione dei farmaci disponibili, discussi in modo più dettagliato nel prossimo articolo di revisione (“Oltre il trattamento di prima linea del carcinoma prostatico metastatico resistente ai castrati”).
Data di pubblicazione: 19 novembre 2019
Leave a Reply