Servier-Flebolinfologia
Scarica questo numero Torna al sommario
trombosi degli arti inferiori:
l’aggiornamento e la corrente
consigli
Bourgoin-Jallieu, Francia
Abstract
Inizialmente, trombosi venosa superficiale (SVT) è stata considerata una malattia benigna o una complicanza comune di vene varicose. Studi recenti hanno dimostrato la potenziale gravità della SVT e definito il suo posto all’interno delle malattie tromboemboliche venose (TEV), insieme alla trombosi venosa profonda (TVP) e all’embolia polmonare (EP). Una TVP concomitante è stata identificata nel 25% -30% dei pazienti alla presentazione e una EP nel 4% -7% dei pazienti. VTE successive sono state riportate nel 3-20% dei pazienti, a seconda della durata del follow-up. Fino a poco tempo fa, sono state testate numerose strategie anticoagulanti, senza alcun beneficio clinico chiaramente dimostrato. Tuttavia, il recente studio CALISTO (Confronto di Arixtra nella trombosi venosa superficiale degli arti inferiori con placebo) ha convalidato un protocollo di terapia anticoagulante basato su fondaparinux, 2,5 mg al giorno per 45 giorni, risultando in raccomandazioni aggiornate per il trattamento della SVT. Questo articolo presenterà un aggiornamento sulla gestione della SVT inferiore della gamba e le attuali raccomandazioni e linee guida. In breve, tutti i pazienti con SVT dovrebbero avere una scansione duplex bilaterale per confermare la diagnosi di SVT, determinare la posizione precisa e l’estensione della SVT e diagnosticare o escludere la presenza di una TVP. Per i pazienti con stenosi sintomatiche SVT almeno 5 cm di lunghezza, si consiglia di prescrivere una dose profilattica di fondaparinux o a basso peso molecolare, eparina per 45 giorni, nessuna terapia anticoagulante (Grado 2B), e quando il costo del trattamento con fondaparinux è accettabile, è consigliato l’uso di fondaparinux 2.5 mg al giorno vs lowmolecular – peso eparina (Grado 2C). Tuttavia, le raccomandazioni e le linee guida hanno assegnato questi trattamenti con un basso grado, e le domande rimangono sulla gestione SVT. Sono stati identificati alcuni fattori di rischio per lo sviluppo successivo di una TEV, ma sono necessarie ulteriori ricerche per definire sottogruppi di pazienti con una maggiore incidenza di TEV dopo una SVT.
Introduzione
La trombosi venosa superficiale (SVT) è stata considerata una malattia benigna o una complicanza comune delle vene varicose; tuttavia, studi recenti hanno dimostrato la loro potenziale gravità e definito il loro posto all’interno delle malattie tromboemboliche venose (TEV), insieme alla trombosi venosa profonda (TVP) e all’embolia polmonare (EP).
La terapia anticoagulante è ampiamente utilizzata oggi al posto dei farmaci antinfiammatori non steroidei (FANS), che sono stati comunemente usati fino all’ultimo decennio. Un recente studio ha, per la prima volta, convalidato un protocollo terapeutico.1 Tuttavia, rimangono domande riguardanti la gestione della SVT: (i) è necessaria una terapia anticoagulante per trattare tutti i pazienti con SVT degli arti inferiori?; (ii) si dovrebbero usare dosi profilattiche o terapeutiche?; (iii) qual è la durata del trattamento raccomandata?; (iv) la gestione dovrebbe essere la stessa per la SVT che si verifica nelle vene varicose e nelle vene non varicose?; (v) possono essere previsti i fattori di rischio delle complicanze da TEV dopo SVT?; e (vi) la chirurgia è ancora indicata per la gestione di una SVT acuta?
Questo articolo presenterà la logica alla base dell’aggiornamento per la gestione delle SVT delle gambe e le attuali raccomandazioni e linee guida.
L’incidenza di trombosi venosa superficiale degli arti inferiori
La SVT è considerata una malattia comune, ma l’incidenza effettiva nella popolazione adulta rimane sconosciuta. Un recente studio, condotto in Francia,2 ha mostrato che il tasso di diagnosi annuale era dello 0,6%. Era più alto nelle donne e aumentava con l’avanzare dell’età indipendentemente dal sesso. Sorprendentemente, il tasso annuale di diagnosi di SVT era inferiore al previsto e inferiore al tasso annuale di diagnosi di TVP (circa la metà di quello della TVP). Secondo un altro studio francese, condotto con metodi comparabili, l’incidenza annuale di TVP e EP degli arti inferiori era rispettivamente dell ‘ 1,24% e dello 0,6%.3
trombosi venosa Superficiale concomitante con trombosi venosa profonda alla presentazione
Il POST (Prospettico Osservazionale Tromboflebite Superficiale) e OPTIMEV studi (Ottimizzazione de l’Interrogatoire dans l’évaluation du risque throMbo – Embolique Veineux), due grandi osservazionali e studi epidemiologici hanno recentemente pubblicato i dati essenziali su SVT.4,5 Nello studio POST sono stati analizzati un totale di 844 pazienti con SVT delle gambe, 4 e una TVP o EP è stata identificata nel 25% dei pazienti con SVT alla presentazione e una TVP prossimale è stata diagnosticata nel 9,7% dei pazienti. Dobbiamo sottolineare che la TVP non era contigua alla SVT nel 41,9% dei pazienti con TVP. Nello studio OPTMEV sono stati arruolati un totale di 788 pazienti con SVT,5 in cui una SVT è stata associata a una TVP al momento dell’inclusione nel 29% dei pazienti, con TVP distale che si è verificata nel 59,5% di questi pazienti (128/215; la posizione esatta della TVP mancava in 12 pazienti).
Questi dati confermano studi precedenti che dimostravano che la TVP era associata a SVT nel 23% -36% dei pazienti e mostrano coerenza tra i diversi studi (Tabella I).2,4-10
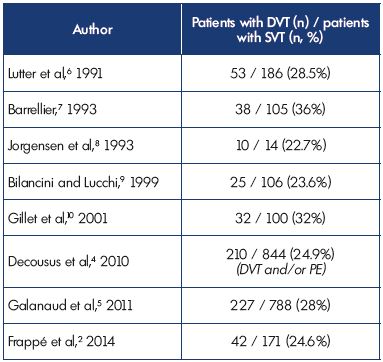
Tabella I. Trombosi venosa superficiale con concomitante trombosi venosa profonda
alla presentazione.
Abbreviazioni: TVP, trombosi venosa profonda; EP, embolia polmonare; SVT,
trombosi venosa superficiale.
Trombosi venosa superficiale associata ad embolia polmonare alla presentazione
All’inclusione, EP sintomatica è stata diagnosticata nel 3,9% e nel 6.9% dei pazienti negli studi POST e OPTIMEV, rispettivamente. Tuttavia, SVT con PE, ma senza TVP, rappresentava solo il 2,2% di tutti gli SVT con TVP o PE. Questi dati confermano i risultati di studi precedenti (Tabella II).2,4 – 7,9,10
In pratica, un esame di scansione duplex è obbligatorio nei pazienti con SVT per confermare la diagnosi (Figura 1), determinare la posizione precisa e l’estensione della SVT e diagnosticare o escludere la presenza di una TVP.
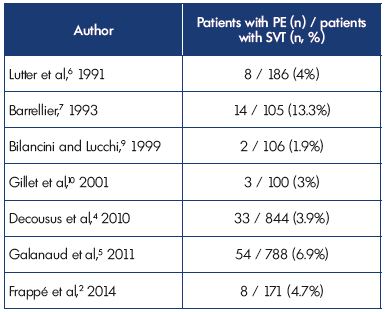
Tabella II. Trombosi venosa superficiale con concomitante embolia polmonare
alla presentazione.
Abbreviazioni: EP, embolia polmonare; SVT, trombosi venosa superficiale.
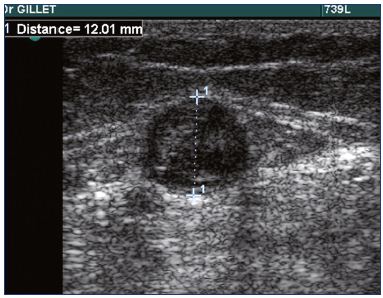
Figura 1. Ecografia della trombosi della piccola vena safena.

Esito e recidiva tromboembolica venosa
In letteratura, il tasso di recidiva tromboembolica varia dal 3% al 20% a seconda della durata del follow-up. In uno studio personale, 13 abbiamo riportato l’insorgenza di TEV sintomatici nel 16,4% dei pazienti con SVT isolata, con un follow-up medio di 14,5 mesi. Gli eventi di TEV includevano TVP (31%), EP (6%), un’altra SVT in un diverso sistema safeno (37,5%) e una SVT ricorrente nello stesso sistema safeno (25%).
Nello studio POST, 4 8.il 3% dei pazienti con SVT isolata all’atto dell’inclusione ha sviluppato almeno 1 evento sintomatico di TEV a 3 mesi (TVP sintomatica, 2,8%; EP sintomatica, 0,5%; estensione sintomatica di SVT, 3,3%; e recidiva sintomatica di SVT, 1,9%). Nello studio OPTIMEV, il 5 3% dei pazienti con SVT isolata e il 5,4% dei pazienti con SVT associata a TVP alla presentazione hanno sviluppato una TEV a 3 mesi; il tasso di TEV è stato del 12,5% al follow-up di 3 anni. Nello studio di Dewar e Panpher, 14 una TVP sintomatica si è verificata nel 4% dei pazienti con SVT isolata ad un follow-up di 6 mesi.
Questi risultati epidemiologici mostrano la potenziale gravità della SVT. Non dovrebbero più essere considerati una condizione benigna. Di conseguenza, il loro posto è stato ora chiaramente definito all’interno delle malattie da TEV.
Fattori di rischio per lo sviluppo di un evento tromboembolico
Un’analisi multivariata del POST studio4 ha identificato come fattori di rischio per una TEV sintomatica a 3 mesi il sesso maschile, l’anamnesi di TVP o EP, precedenti tumori e assenza di vene varicose, inclusa la recidiva o l’estensione della TEV. Nello studio STENOX (tromboflebite superficiale trattata con enoxaparina), 15 anamnesi di TEV (TVP o EP), sesso maschile e grave insufficienza venosa cronica sono stati identificati come fattori predittivi indipendenti per una TEV a 3 mesi. Solo l’insufficienza venosa cronica grave era un fattore predittivo indipendente per TVP o EP. In un’analisi aggregata degli studi POST e OPTIMEV,16 Galanaud et al hanno mostrato che il sesso maschile, il cancro, la storia personale di TEV e il coinvolgimento saphenofemorale o saphenopopliteo aumentavano significativamente il rischio di una successiva TEV o TVP/ EP in un’analisi univariata. Nelle analisi multivariate, solo il sesso maschile ha aumentato significativamente il rischio di una successiva recidiva di TEV o TVP / EP. Per il cancro e una storia personale di TEV, gli hazard ratio aggiustati erano solo leggermente al di sotto del livello di significatività statistica (P=0,06 per entrambi), suggerendo che, per questi fattori, lo studio mancava semplicemente di potenza statistica sufficiente.
Nello studio STEFLUX (Tromboembolismo superficiale FLUXum),17 con un indice di massa corporea (IMC) compreso tra 25 e 30 kg/m2 e un composto di una precedente SVT e/o TEV e/o storia familiare di TEV sono stati identificati come fattori di rischio indipendenti significativi per un evento TEV (composto di TVP sintomatica e asintomatica, EP e recidiva o estensione di SVT).
Stato della vena
È stato riportato che lo stato della vena varicosa influenza il rischio di mostrare TVP alla presentazione. Negli studi POST4 e OPTIMEV, 5 SVT che si verificano in una vena non varicosa (NVV-SVT) sono stati più spesso associati a una concomitante TVP o EP rispetto a SVT che si verificano in una vena varicosa (VV-SVT). Risultati simili sono stati riportati da Gorty et al.
Al follow-up di 3 mesi nello studio OPTIMEV, NVV-SVT isolata non è stata associata ad un rischio più elevato di esiti avversi (es. morte, recidiva di TEV e sanguinamento). La NVV-SVT isolata ha avuto una più alta associazione con recidiva sintomatica di TVP o EP (2,7% vs 0,6%), ma questo risultato non ha raggiunto la significatività statistica (P=0,07).
Nello studio POST, l’assenza di vene varicose è stata identificata come un fattore di rischio per il successivo sviluppo di un TEV sintomatico in pazienti con SVT sintomatico isolato alla presentazione (P=0,049). Nello studio STEFLUX, 17 l’assenza di vene varicose è stata un fattore di rischio per TEV (P=0,004) dopo che il trattamento con eparina a basso peso molecolare è stato interrotto.
Nel gruppo placebo dello studio CALISTO (Confronto di Arixtra nella trombosi venosa superficiale degli arti inferiori con placebo),1 le complicanze tromboemboliche si sono verificate più spesso quando la SVT ha coinvolto la grande vena safena (GSV), è stata estesa entro 10 cm dalla giunzione safenofemorale (SFJ), ha coinvolto vene sopra il ginocchio e in pazienti con una storia di TEV.
La stasi venosa è il meccanismo primario della SVT nei pazienti con vene varicose. L’infiammazione può svolgere un ruolo essenziale nella formazione di trombi in pazienti senza vene varicose; in tal modo, conferendo un rischio più elevato per un tromboembolismo più clinicamente grave. Lo screening per la trombofilia non è raccomandato per la gestione di routine di pazienti con NVV-SVT, sebbene i dati della letteratura mostrino che la trombofilia era frequente in questa situazione. In uno studio prospettico personale, 10 abbiamo identificato la trombofilia nel 50% dei pazienti con NVV-SVT, mentre solo il 15% dei pazienti con VV-SVT aveva trombofilia. In un altro studio prospettico che ha coinvolto 42 pazienti con NVV-SVT, 19 abbiamo identificato la trombofilia in 20 (47,6%) pazienti. La trombofilia più comune era dovuta alla mutazione eterozigote del fattore V di Leiden. In uno studio che ha coinvolto 63 pazienti con NVV-SVT isolata,20 Martinelli et al hanno identificato la trombofilia nel 30% dei pazienti. Lo screening per la trombofilia è consigliabile, dopo l’esclusione di un cancro occulto, specialmente per i pazienti con progressione del trombo nonostante un’appropriata terapia anticoagulante.11,21
Trattamento della trombosi venosa superficiale
Il trattamento della SVT è sempre stato un argomento controverso. Sono riportate grandi variazioni nel trattamento, in particolare per quanto riguarda la terapia anticoagulante. Lo studio POST4, condotto in Francia tra marzo 2005 e ottobre 2006, ha fornito informazioni interessanti sul trattamento della SVT. Un totale di 634 pazienti aveva una SVT isolata al momento dell’inclusione. Informazioni sul trattamento ricevuto durante il periodo di osservazione di 3 mesi erano disponibili per 597 pazienti, con il 90,5% dei pazienti che avevano ricevuto uno o più farmaci anticoagulanti. Dei pazienti trattati con terapia anticoagulante, il 63% ha ricevuto dosi terapeutiche, il 36,7% dosi profilattiche e il 16,8% antagonisti della vitamina K. La durata del trattamento è stata molto variabile. Un totale di 47.il 2% dei pazienti ha ricevuto un FANS topico, l ‘ 8,2% un FANS orale e il 10% ha subito un intervento chirurgico venoso (stripping o legatura elevata).
Questi dati hanno mostrato la necessità di chiarire il ruolo della terapia anticoagulante nella gestione della SVT. L’uso della terapia anticoagulante in pazienti che presentano un SVT è stato riportato per la prima volta nel 1962 da Zollinger et al, 22 dopo aver osservato l’insorgenza di un EP, che è stato fatale in 34 (10,1%) di una serie di 335 pazienti con SVT. Fino a poco tempo fa, sebbene fossero state testate numerose strategie anticoagulanti, tra cui eparina non frazionata o eparina a basso peso molecolare, a dosi profilattiche o terapeutiche per varie durate, nessuna aveva chiaramente dimostrato alcun beneficio clinico.
Lo studio stenox23 è stato uno studio randomizzato in doppio cieco che ha coinvolto 427 pazienti, confrontando eparina a basso peso molecolare (enoxaparina a dosi terapeutiche e profilattiche) con FANS e placebo. I pazienti sono stati trattati per 10 giorni, con un follow-up di 3 mesi. A 10 giorni, c’erano più TEV nel gruppo placebo (P24 ha confrontato dosi terapeutiche vs profilattiche di nodraparin in 163 pazienti con SVT isolato nel GSV e i pazienti sono stati trattati per 1 mese. Al follow-up di 3 mesi, i risultati sono stati simili in entrambi i gruppi (7,2% e 8,6% di insorgenza di un TEV, rispettivamente; P = 0,7), non mostrando alcun beneficio del dosaggio terapeutico. Un fenomeno di” catch-up ” o rimbalzo è stato osservato durante il follow-up, poiché sono stati riportati molti TEV, specialmente nel gruppo di pazienti trattati con il dosaggio terapeutico. Un fenomeno di “catch-up” è stato osservato anche dopo la sospensione del trattamento con eparina a basso peso molecolare dopo 1 mese nello studio STEFLUX.25 Questi risultati, come quelli dello studio STENOX, chiedono la scelta di dosi profilattiche di eparina a basso peso molecolare in SVT. Il verificarsi della maggior parte dei VTEs durante i 2 e 3 mesi dopo l’interruzione del trattamento con eparina a basso peso molecolare nel gruppo che riceve dosi terapeutiche, evidenzia ancora una volta il problema della durata ottimale della terapia anticoagulante.
Lo studio randomizzato, in doppio cieco CALISTO 1 ha confrontato fondaparinux 2,5 mg al giorno per 45 giorni con placebo in 3002 pazienti con SVT sintomatica isolata degli arti inferiori di almeno 5 cm di lunghezza. I principali criteri di esclusione erano il trattamento del cancro entro i 6 mesi precedenti, la TVP o EP entro i 6 mesi precedenti, la SVT localizzata entro 3 cm dall’SFJ e l’insufficienza renale grave (clearance della creatinina 26 la dose di 2,5 mg di fondaparinux è stata selezionata in base all’idea che una dose profilattica sarebbe stata sufficiente per trattare i pazienti con SVT. Inoltre, questa dose è stato dimostrato di essere più efficace nella prevenzione di VTEs dopo importanti interventi di chirurgia ortopedica di una dose profilattica di basso peso molecolare, eparina, e più efficace la dose terapeutica di basso peso molecolare, eparina in pazienti con sindromi coronariche acute, suggerendo che 2,5 mg di fondaparinux sarebbe partita il 2008 American College of Chest Physicians (ACCP) recommendations27 che sostengono l’uso di profilattici o a dosi intermedie di basso peso molecolare, eparina per il trattamento di pazienti con SVT. La durata di 45 giorni è stata scelta perché un periodo di trattamento di 30 giorni o meno potrebbe essere troppo breve, poiché la maggior parte dei TEV sintomatici si verificano dopo l’interruzione del trattamento. L ‘outcome primario di efficacia era un composto di morte per qualsiasi causa, una EP sintomatica, una TVP sintomatica, un’ estensione sintomatica alla SFJ o una recidiva sintomatica di SVT al giorno 47. C’è stato un periodo di follow-up di 77 giorni per i pazienti.
L ‘ outcome primario di efficacia si è verificato nello 0,9% dei pazienti del gruppo fondaparinux e in 5.9% nel gruppo placebo(P28

È interessante notare il cambiamento delle raccomandazioni rispetto alle linee guida ACCP del 2008.27 Tuttavia, dobbiamo tenere conto del fatto che si tratta di raccomandazioni di basso grado (Grado 2B o 2C).
Nell’aggiornamento della revisione sistematica del database Cochrane su “Trattamento per tromboflebite superficiale della gamba”, 29,30 Di Nisio et al hanno raggiunto le stesse conclusioni. Questa revisione si è basata sull’analisi di 30 studi randomizzati controllati che hanno coinvolto 6507 partecipanti con SVT delle gambe. Gli autori concludono che una dose profilattica di fondaparinux, somministrata per 6 settimane, sembra essere una valida opzione terapeutica per la SVT delle gambe. Le prove su trattamenti orali, trattamento topico o chirurgia sono troppo limitate e non forniscono informazioni per l’uso nella pratica clinica sugli effetti di questi trattamenti in termini di progressione di TEV e SVT.
Chirurgia contro terapia anticoagulante
Una revisione degli studi che confrontano la chirurgia con la terapia anticoagulante non mostra alcun beneficio per il trattamento chirurgico. I tassi di progressione della SVT erano simili, mentre l’incidenza di TEV e complicanze era più elevata con la chirurgia.31 Lozano et al non hanno mostrato alcuna differenza tra la chirurgia e l’enoxaparina per 4 settimane.32
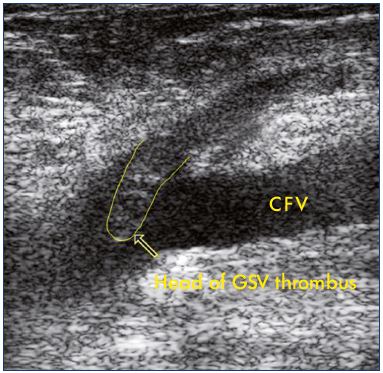
Figura 2. Ultrasuoni di un’estensione di una trombosi della
grande vena safena nella vena femorale comune.
Abbreviazioni: CFV, common femoral vein; GSV, great safenous vein
Figura 3. Trombosi della giunzione saphenofemoral.
Immagine gentilmente concessa dal dott.

In pratica, la maggior parte degli esperti consiglia di trattare pazienti con SVT esteso al SFJ o SPJ con terapia anticoagulante a dosi terapeutiche per 3 mesi.
Conclusione
La SVT non dovrebbe più essere considerata una malattia benigna. Recenti studi epidemiologici, che hanno incluso un gran numero di pazienti, hanno dimostrato la potenziale gravità delle SVT e hanno chiaramente definito il loro posto all’interno delle malattie da TEV. Una TVP concomitante è stata identificata nel 25% -30% dei pazienti alla presentazione e una EP nel 4% -7% dei pazienti. Di conseguenza, tutti i pazienti con SVT dovrebbero avere scansione duplex bilaterale per confermare la diagnosi di SVT, determinare la posizione precisa e l’estensione della SVT e diagnosticare o escludere la presenza di una TVP. Oggi, la gestione della SVT è cambiata, con la terapia anticoagulante ampiamente utilizzata al posto dei FANS. Fino al recente studio CALISTO, nessun protocollo anticoagulante aveva dimostrato un chiaro beneficio clinico. Le raccomandazioni sono state aggiornate dopo che lo studio CALISTO ha convalidato il protocollo di terapia anticoagulante basato su fondaparinux 2,5 mg al giorno per 45 giorni. Per i pazienti con SVT sintomatico delle gambe di almeno 5 cm di lunghezza, si raccomanda una dose profilattica di fondaparinux o eparina a basso peso molecolare per 45 giorni senza anticoagulazione (Grado 2B). Quando il costo del trattamento con fondaparinux è accettabile, si raccomanda l’uso di fondaparinux 2,5 mg al giorno per una dose profilattica di eparina a basso peso molecolare (Grado 2C). Tuttavia, le raccomandazioni e le linee guida sono di basso livello e rimangono questioni riguardanti la gestione SVT. Sono stati identificati alcuni fattori di rischio per lo sviluppo successivo di una TEV, ma sono necessarie ulteriori ricerche per definire chiaramente sottogruppi di pazienti con una maggiore incidenza di TEV dopo SVT.

2. Frappé P, Buchmuller-Cordier A, Bertoletti L, et al; Gruppo di studio STEPH. Tasso di diagnosi annuale di trombosi venosa superficiale degli arti inferiori: lo studio basato sulla comunità STEPH. J Thrombb Haemost. 2014;12:831-838.
3. Oger E; Gruppo di studio EPI-GETBO. Incidenza del tromboembolismo venoso: uno studio basato sulla comunità nella Francia occidentale. Thrombb Haemost. 2000;83:657- 660.
4. D ecousus H, Quéré I, Presles E, et al; Gruppo di studio POST. Trombosi venosa superficiale e tromboembolia venosa: un ampio studio epidemiologico prospettico. Ann Stagista Med. 2010;152:218-224.
5. G alanaud JP, Genty C, Sevestre MA, et al; OTTIMEV Investigatori SFMV. Fattori predittivi per trombosi concomitante deepvein e recidiva tromboembolica venosa sintomatica in caso di trombosi venosa superficiale. Thrombb Haemost. 2011;105:31-39.
6. I nostri servizi sono a vostra completa disposizione. Tromboflebite superficiale diagnosticata mediante scansione duplex. Chirurgia. 1991;100:42-46.
7. Barrellier MT. Trombosi veineuses superficielles des membres inférieurs . Effettivo Vasc Int. 1993;17:7-9.
8. Jorgensen JO, Hanel KC, Mogan AM, Hunt JM. L’incidenza di trombosi venosa profonda in pazienti con tromboflebite superficiale degli arti inferiori. J Vasc Surg. 1993;18:70-73.
9. Bilancini S, Lucchi M. Les trombosi veineuses superficielles sont -les polymorphes ? Phlébologie. 1999;52:41-43.
10. G illet JL, Perrin M, Cayman R. Trombosi venosa superficiale degli arti inferiori: analisi prospettica in 100 pazienti . J Mal Vasc. 2001;26:16-22.
11. Kalodiki E, Stvrtinova V, Allegra C, et al. Trombosi venosa superficiale: una dichiarazione di consenso. Int Angiolo. 2012;31:203-216.
12. Nicolaides A. Trombosi venosa superficiale nella prevenzione e nel trattamento del tromboembolismo venoso. Int Angiolo. 2013;32:237-242.
13. G illet JL, Perrin M, Cayman R. Recidiva tromboembolica dopo tromboflebite superficiale degli arti inferiori. J Flebologia. 2002;2:103-118.
14. D ewar C, Panpher S. Incidenza di trombosi venosa profonda in pazienti con diagnosi di tromboflebite superficiale dopo la presentazione ad un servizio di trombosi venosa profonda ambulatoriale di pronto soccorso. Emerg Med J. 2010; 27:758-761.
15. Quenet S, Laporte S, Décousus H, Leizorovicz A, Epinat M, Mismetti P; Gruppo STENOX. Fattori predittivi delle complicanze trombotiche venose in pazienti con trombosi venosa superficiale isolata. J Vasc Surg. 2003; 38: 944-949.
16. G alanaud JP, Bosson JL, Genty C, et al. Trombosi venosa superficiale e tromboembolia venosa ricorrente: analisi aggregata di due studi osservazionali. J Thrombb Haemost. 2012;10:1004-1011.
17. Cosmi B, Filippini M, Campana F, et al; Ricercatori di STEFLUX. Fattori di rischio per eventi ricorrenti in soggetti con trombosi venosa superficiale nello studio clinico randomizzato SteFlux (Tromboembolia superficiale Fluxum). Thromb Res. 2014;133:196-202.
18. G orty S, Patton-Adkins J, DaLanno M, Starr J, Dean S, Satiani B. Trombosi venosa superficiale degli arti inferiori: analisi dei fattori di rischio, recidiva e ruolo dell’anticoagulazione. Vasc Med. 2004;9:1-6.
19. G illet JL, Allaert FA, Perrin M. Tromboflebite superficiale nelle vene non varicose degli arti inferiori. Un’analisi prospettica in 42 pazienti . J Mal Vasc. 2004;29:263-272.
20. Martinelli I, Cattaneo M, Taioli E, de Stefano V, Chiusolo P, Mannucci PM. Fattori di rischio genetici per trombosi venosa superficiale. Thrombb Haemost. 1999;82:1215-1217.
21. Milio G, Siragusa S, Malato A, Grimaudo S, Pinto A. Trombosi venosa superficiale: ruolo della carenza ereditaria di anticoagulanti naturali nell’estensione delle vene profonde. Int Angiolo. 2009;28:298- 302.
22. Zollinger RW, Williams RD, Briggs FARE. Problemi nella diagnosi e nel trattamento della tromboflebite. Arch Surg. 1962; 85: 34-40.
23. D ecousus H; Gruppo di studio enoxaparina. Un pilota randomizzato confronto in doppio cieco di un eparina a basso peso molecolare, un agente anti-infiammatorio non steroideo, e placebo nel trattamento della trombosi venosa superficiale. Arch Int Med. 2003;163:1657-1663.
24. Prandoni P, Tormene D, Pesavento R; Vesalio Investigators Group. Alte vs. basse dosi di eparina a basso peso molecolare per il trattamento della trombosi venosa superficiale delle gambe: uno studio randomizzato in doppio cieco. J Thrombb Haemost. 2005;3:1152-1157.
25. Cosmi B, Filippini M, Tonti D, Avruscio G, Ghirarduzzi A, Bucherini E; Investigatori di STEFLUX. Studio randomizzato di eparina a basso peso molecolare (parnaparina) per trombosi venosa superficiale: STEFLUX (tromboembolia superficiale e Fluxum). J Thrombb Haemost. 2012;10:1026-1035.
26. D ecousus H, Frappé P, Accassat S, et al. Epidemiologia, diagnosi, trattamento e gestione della trombosi venosa superficiale delle gambe. Migliore res di Pract Clin Haematol. 2012;25:275-284.
27. Il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. Terapia antitrombotica per la malattia tromboembolica venosa: American College of Chest Physicians Evidence – Based Clinical Practice Guidelines (8th Edition). Petto. 2008;133 (suppl 6): 454S-545S.
28. Kearon C, Akl EA, Comerota AJ, et al; American College of Chest Physicians. Terapia antitrombotica per la malattia da TEV: Terapia antitrombotica e prevenzione della trombosi, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Petto. 2012;141 (suppl 2): e419S-e494S.
29. D i Nisio M, Wichers IM, Middeldorp S. Trattamento per tromboflebite superficiale della gamba. Cochrane Database Syst Rev. 2013; 30; 4:CD004982.
30. D i Nisio M, Middeldorp S. Trattamento della tromboflebite superficiale degli arti inferiori. JAMA. 2014;311:729- 730.
31. Sullivan V, Denk PM, Sonnad SS, Eagleton MJ, Wakefield TW. Legatura contro anticoagulazione: trattamento della tromboflebite superficiale sopra il ginocchio che non coinvolge il sistema venoso profondo. J Am Coll Surg. 2001;193:556-562.
32. Lozano FS, Almazan A. Eparina a basso peso molecolare contro disconnessione safenofemorale per il trattamento della tromboflebite safena superiore sopra il ginocchio: uno studio prospettico. Vasc Chirurgia endovascolare 2003;37: 415-420.
33. Chengelis DL, Bendick PJ, Glover JL, Brown OW, Ranval TJ. Progressione della trombosi venosa superficiale a trombosi venosa profonda. J Vasc Surg. 1996;24: 745-749.
34. Hingorani A, Ascher E. Tromboflebite venosa superficiale. In: Gloviczki P, ed. Manuale dei disturbi venosi. Linee guida del Forum venoso americano. 3a ed. Londra, Regno Unito: Hodder Arnold; 2009: 314-319.
Leave a Reply