NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. Sono utilizzati nella produzione di spray aerosol, agenti espandenti per schiume e materiali di imballaggio, come solventi e come refrigeranti. I CFC sono classificati come alocarburi, una classe di composti che contengono atomi di carbonio e atomi di alogeno. Le singole molecole CFC sono etichettate con un sistema di numerazione unico. Ad esempio, il numero CFC di 11 indica il numero di atomi di carbonio, idrogeno, fluoro e cloro (ad esempio CCl3F come CFC-11). Il modo migliore per ricordare il sistema è la “regola di 90” o aggiungere 90 al numero CFC dove la prima cifra è il numero di atomi di carbonio (C), la seconda cifra è il numero di atomi di idrogeno (H) e la terza cifra è il numero degli atomi di fluoro (F). Il numero totale di atomi di cloro(Cl) è calcolato dall’espressione: Cl = 2 (C+1) – H – F. Nell’esempio CFC-11 ha un carbonio, nessun idrogeno, un fluoro e quindi 3 atomi di cloro.
I frigoriferi alla fine del 1800 e all’inizio del 1900 usavano i gas tossici, l’ammoniaca (NH3), il cloruro di metile (CH3Cl) e l’anidride solforosa (SO2), come refrigeranti. Dopo una serie di incidenti mortali nel 1920, quando il cloruro di metile trapelato dai frigoriferi, una ricerca di un sostituto meno tossico iniziato come uno sforzo di collaborazione di tre società americane – Frigidaire, General Motors, e Du Pont. I CFC furono sintetizzati per la prima volta nel 1928 da Thomas Midgley, Jr.di General Motors, come sostanze chimiche più sicure per i frigoriferi utilizzati nelle grandi applicazioni commerciali1. Frigidaire è stato rilasciato il primo brevetto, numero 1.886.339, per la formula per CFC il 31 dicembre 1928. Nel 1930, General Motors e Du Pont formarono la Kinetic Chemical Company per produrre Freon (un nome commerciale Du Pont per CFC) in grandi quantità. Nel 1935 Frigidaire e i suoi concorrenti avevano venduto 8 milioni di nuovi frigoriferi negli Stati Uniti usando Freon-12 (CFC-12) prodotto dalla Kinetic Chemical Company e da quelle aziende che erano autorizzate a produrre questo composto. Nel 1932 la Carrier Engineering Corporation utilizzò il Freon-11 (CFC-11) nella prima unità di condizionamento dell’aria domestica autonoma al mondo, chiamata “Atmospheric Cabinet”.; A causa del record di sicurezza CFC per la non tossicità, il Freon è diventato il refrigerante preferito nei grandi sistemi di climatizzazione. I codici di salute pubblica in molte città americane sono stati rivisti per designare il Freon come l’unico refrigerante che potrebbe essere utilizzato negli edifici pubblici. Dopo la seconda guerra mondiale, i CFC sono stati utilizzati come propellenti per spray per insetti, vernici, balsami per capelli e altri prodotti sanitari. Durante la fine degli anni 1950 e l’inizio degli anni 1960 i CFC hanno reso possibile una soluzione economica al desiderio di aria condizionata in molte automobili, case ed edifici per uffici. Successivamente, la crescita nell’uso di CFC è decollata in tutto il mondo con un picco di vendite annuali di circa un miliardo di dollari (Stati Uniti) e più di un milione di tonnellate di CFC prodotti.
Mentre i CFC sono sicuri da usare nella maggior parte delle applicazioni e sono inerti nella bassa atmosfera, subiscono una reazione significativa nell’atmosfera superiore o nella stratosfera. Nel 1974, due chimici dell’Università della California, il professor F. Sherwood Rowland e il Dott. Mario Molina, ha dimostrato che i CFC potrebbero essere una delle principali fonti di cloro inorganico nella stratosfera dopo la loro decomposizione fotolitica per radiazione UV. Inoltre, parte del cloro rilasciato diventerebbe attivo nel distruggere l’ozono nella stratosfera2. L’ozono è un gas traccia situato principalmente nella stratosfera (vedi ozono). L’ozono assorbe radiazioni ultraviolette nocive nelle lunghezze d’onda comprese tra 280 e 320 nm della banda UV-B che possono causare danni biologici nelle piante e negli animali. Una perdita di ozono stratosferico provoca radiazioni UV-B più dannose che raggiungono la superficie terrestre. Il cloro rilasciato dai CFC distrugge l’ozono nelle reazioni catalitiche in cui 100.000 molecole di ozono possono essere distrutte per atomo di cloro.
Un grande esaurimento primaverile di ozono stratosferico stava peggiorando ogni anno successivo. Questa perdita di ozono è stata descritta nel 1985 dal ricercatore britannico Joe Farman e dai suoi colleghi3. È stato chiamato “il buco dell’ozono antartico” da altri. Il buco nell’ozono era diverso dalla perdita di ozono nelle midlatitudini. La perdita è stata maggiore sopra Antartico rispetto alle midlatitudes a causa di molti fattori: le temperature insolitamente fredde della regione, l’isolamento dinamico di questa “holeî” e le reazioni sinergiche di cloro e bromo4. La perdita di ozono è aumentata anche nelle regioni polari a seguito di reazioni che coinvolgono nubi stratosferiche polari (PSC)5 e nelle medie latitudini a seguito di eruzioni vulcaniche. La necessità di controllare i CFC divenne urgente.
Nel 1987, 27 nazioni hanno firmato un trattato ambientale globale, il Protocollo di Montreal per ridurre le sostanze che riducono lo strato di Ozono6, che aveva una disposizione per ridurre i livelli di produzione 1986 di questi composti del 50% prima dell’anno 2000. Questo accordo internazionale includeva restrizioni sulla produzione di CFC-11, -12, -113, -114, -115, e gli Halon (sostanze chimiche utilizzate come agenti estinguenti). Un emendamento approvato a Londra nel 1990 era più incisivo e chiedeva l’eliminazione della produzione entro il 2000. I solventi clorurati, il cloroformio di metile (CH3CCl3) e il tetracloruro di carbonio (CCl4) sono stati aggiunti all’emendamento di Londra.
Grandi quantità di cloro stratosferico reattivo sotto forma di monossido di cloro (ClO) che potrebbe derivare solo dalla distruzione dell’ozono da parte dei CFC nella stratosfera sono state osservate da strumenti a bordo del velivolo ER-2 della NASA e UARS (Upper Atmospheric Research Satellite) su alcune regioni del Nord America durante l’inverno del 19927,8. La preoccupazione ambientale per i CFC deriva dalla loro lunga durata atmosferica (55 anni per CFC-11 e 140 anni per CFC-12, CCl2F2)9 che limita la nostra capacità di ridurre la loro abbondanza nell’atmosfera e la conseguente perdita futura di ozono. Ciò ha portato all’emendamento di Copenaghen che ha ulteriormente limitato la produzione ed è stato approvato più tardi nel 1992. La produzione di queste sostanze chimiche si è conclusa per la maggior parte il 1 ° gennaio 1996. Le uniche eccezioni approvate sono state per la produzione nei paesi in via di sviluppo e per alcune applicazioni esentate in medicina (ad esempio, inalatori per l’asma) e nella ricerca. Il Protocollo di Montreal includeva disposizioni di applicazione applicando sanzioni economiche e commerciali qualora un paese firmatario commercializzasse o producesse tali sostanze chimiche vietate. Un totale di 148 paesi firmatari hanno ora firmato il Protocollo di Montreal. Le misurazioni atmosferiche CFC-11 e CFC-12 riportate nel 1993 hanno mostrato che i loro tassi di crescita stavano diminuendo a seguito di riduzioni volontarie e obbligatorie delle emissioni9. Molti CFC e solventi clorurati selezionati si sono livellati (figura 1) o sono diminuiti di concentrazione entro il 1994910.
La domanda di CFC è stata soddisfatta dal riciclaggio e dal riutilizzo delle scorte esistenti di CFC e dall’uso di sostituti. Alcune applicazioni, ad esempio lo sgrassaggio di metalli e la pulizia di solventi per circuiti stampati, che una volta utilizzati CFC ora utilizzano fluidi privi di alocarbonio, acqua (a volte come vapore) e acidi citrico diluiti. L’industria ha sviluppato due classi di sostituti alocarbonici: gli idroclorofluorocarburi (HCFC) e gli idrofluorocarburi (HFC). Gli HCFC includono atomi di idrogeno oltre a cloro, fluoro e atomi di carbonio. Il vantaggio dell’utilizzo di HCFC è che l’idrogeno reagisce con idrossile troposferico (OH), con conseguente durata atmosferica più breve. HCFC-22 (CHClF2) ha una durata atmosferica di circa 13 anni11 ed è stato utilizzato nel condizionamento d’aria domestico a bassa domanda e in alcune applicazioni di refrigerazione dal 1975. Tuttavia, gli HCFC contengono ancora cloro che consente loro di distruggere l’ozono. L’emendamento di Copenaghen chiede che la loro produzione venga eliminata entro il 2030. Gli HFC sono considerati uno dei migliori sostituti per ridurre la perdita di ozono stratosferico a causa della loro breve durata e della mancanza di cloro. Negli Stati Uniti, HFC-134a è utilizzato in tutti i nuovi condizionatori d’aria domestici dell’automobile. Ad esempio, HFC-134a sta crescendo rapidamente nel 1995 ad un tasso di crescita di circa il 100% all’anno con una vita atmosferica di circa 12 anni12. (La “regola del 90” si applica anche per la formula chimica di HCFC e HFC.)
L’uso dei CFC, di alcuni solventi clorurati e degli halon dovrebbe diventare obsoleto nel prossimo decennio se il Protocollo di Montreal viene osservato da tutte le parti e vengono utilizzati sostituti. La scienza che è diventata la base per il Protocollo di Montreal ha portato al Premio Nobel per la chimica 1995. Il premio è stato assegnato congiuntamente ai Professori F. S. Rowland all’Università della California a Irvine, M. Molina al Massachusetts Institute of Technology di Cambridge e Paul Crutzen al Max-Planck-Institute for Chemistry di Magonza, in Germania, per il loro lavoro in chimica atmosferica, in particolare per quanto riguarda la formazione e la decomposizione dell’ozono (in particolare, dai CFC e dagli ossidi di azoto).
1Midgley, T., e Henne, A., fluoruri organici come refrigeranti, chimica industriale e ingegneristica, 22, 542-547, 1930.
2Molina, M. J., e F. S. Rowland, lavello stratosferico per clorofluorometani: Atomo di cloro catalizzato distruzione dell’ozono, Natura, 249, 810-814, 1974.
3Farman, JC, BG Gardiner e JD Shanklin, Grandi perdite di ozono totale in Antartide rivelano l’interazione stagionale ClOx/NOx, Nature, 315,207-210, 1985.
4McElroy, MB, RJ Salawitch, SC Wofsy e JA Logan, Riduzioni dell’ozono antartico a causa delle interazioni sinergiche di cloro e bromo, Nature, 321, 759-762, 1986.
5Solomon, S., R. R. Garcia, F. S. Rowland e D. J. Wuebbles, On the depletion of Antarctic ozone, Nature, 321, 755-758, 1986.
6protocollo reale sulle sostanze che riducono lo strato di ozono, 15 pp, Programma ambientale delle Nazioni Unite (UNEP), New York, 1987.
7Toohey, DW, LM Avallone, LR Lait, PA Newman, MR Schoeberl, DW Fahey, EL Woodbridge e JG Anderson, L’evoluzione stagionale del cloro reattivo nella stratosfera dell’emisfero settentrionale, Scienza, 261, 1134-1136, 1993.
8Waters, J., L. Froidevaux, W. Read, G. Manney, L. .Il suo nome deriva dal greco antico, “Elson”, “D. Flower”, “R. Jarnot” e ” R. Harwood, Stratospheric CLO andozone dal Microwave Limb Sounder sul satellite di ricerca dell’atmosfera superiore, Nature, 362, 597-602, 1993.
9Elkins, J. W., T. M. Thompson, T. H. Swanson, J. H. Butler, B. D. Hall, S. O. Cummings, D. A. Fisher, e A. G. Raffo, Diminuzione dei tassi di crescita dei clorofluorocarburi atmosferici 11 e 12, Natura , 364, 780-783, 1993.
10Prinn, R. G., R. F. Weiss, B. R. Miller, J. Huang, F. N. Alyea, D. M. Cunnold, P. J. Fraser, D. E. Hartley, e P. G. Simmonds, Atmospheric trends and lifetimes of CH3CCl3 and global OH concentrations, Science, 269, 187-192, 1995.
11Montzka, SA, R. C. Myers, J. H. Butler, S. C. Cummings, e J. W. Elkins, distribuzione troposferica globale e scala di calibrazione di HCFC-22, Geophysical Research Letters, 20 (8), 703-706, 1993.
12Montzka, SA, R. C. Myers, J. H. Butler, J. W. Elkins, LT Lock, A. D. Clarke, e A. H. Goldstein, Osservazioni di HFC-134a nella troposfera remota, Geophysical Research Letters, 23, 169-172, 1996.
Lettura aggiuntiva suggerita:
Cagin, S. e P. Dray, Between Earth and Sky: How CFC changed our world and threatened the ozone layer, 512 pp., Pantheon Press, New York, 1993.
Valutazione scientifica della riduzione dell’ozono: 1994, a cura di D. L. Albritton, R. T. Watson e R. J. Aucamp, 37, 451 pp., Organizzazione Meteorologica Mondiale (OMM), Ginevra, 1995.
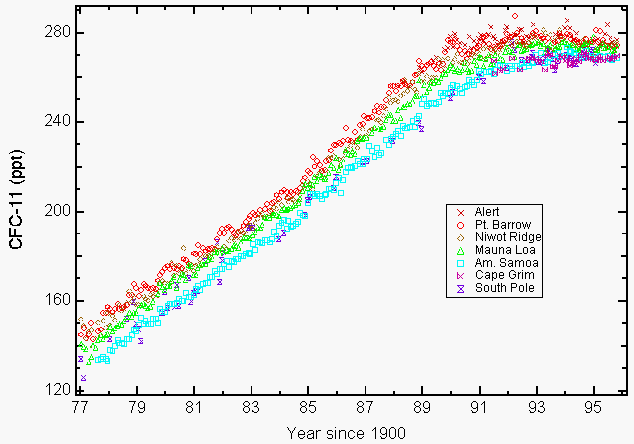
Figura 1: L’accumulo di clorofluorocarbonio-11 (CFC-11) nell’atmosfera si attenua a seguito di riduzioni volontarie e obbligatorie delle emissioni. Mezzi mensili riportati come rapporti di miscelazione a secco in parti per trilione (ppt) per CFC-11 a livello del suolo per quattro stazioni NOAA/CMDL (Pt. Barrow, Alaska; Mauna Loa, Hawaii; Cape Matatula, Samoa Americane; e Polo Sud) e tre stazioni cooperative (Alert, Territori del Nord-ovest, Canada (Atmospheric Environment Service); Niwot Ridge, Colorado (Università del Colorado); Cape Grim Baseline Air Pollution Station, Tasmania, Australia, (Commonwealth Scientific and Industrial Research Organization)9. (Per gentile concessione di NOAA / CMDL)
Leave a Reply