Legame chimico
I legami chimici sono le attrazioni tra gli atomi che li tengono insieme per formare composti. Esistono tre tipi principali di legame: legami covalenti che legano insieme composti molecolari, legami ionici che legano sali e cristalli ionici e legami metallici che legano gli atomi dei metalli.
Molecole e legami covalenti
La maggior parte dei combustibili, delle materie plastiche e dei prodotti naturali sono composti molecolari, fatti di atomi legati insieme in molecole. Il tipo di legame che unisce gli atomi di una molecola è il legame covalente, che si verifica quando gli elettroni esterni di due atomi sono condivisi tra loro, creando un’attrazione tra i due atomi.
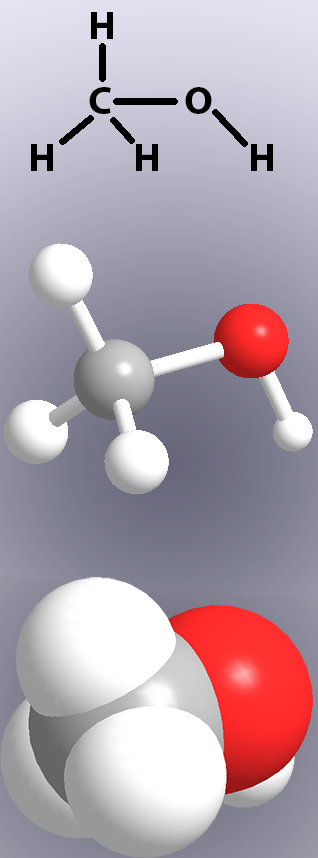
I legami covalenti sono mostrati nelle strutture chimiche da linee (Figura 1, in alto) e nei modelli mostrando “bastoni” o la sovrapposizione degli atomi (Figura 1, al centro e in basso).
Gli elettroni in un legame covalente non sono sempre condivisi equamente tra i due atomi. Quando la condivisione è disuguale, un atomo avrà una leggera carica positiva e l’altro atomo sarà leggermente negativo. Questo casse un piccolo dipolo elettrico-molecole che contengono un dipolo sono composti polari. Se una molecola è polare o non polare influenzerà le sue proprietà, come i punti di fusione e di ebollizione e il legame dell’idrogeno.
Per saperne di più su legame covalente sul LibreText chimica.
Legame ionico e metallico
Mentre il legame covalente comporta la condivisione di elettroni tra due atomi, il legame ionico comporta il trasferimento completo di elettroni da un atomo all’altro, creando ioni positivi e negativi. Questi ioni sono quindi tenuti insieme dall’attrazione tra le loro cariche opposte. I composti ionici formano cristalli basati su queste attrazioni.
Il legame metallico comporta la condivisione completa degli elettroni di valenza degli atomi metallici, creando un “mare di elettroni” in cui gli elettroni sono liberi di muoversi. Questo è parte della ragione per l’alta conduttività dei metalli. Per saperne di più sul legame metallico al LibreText chimica
Energia e legami chimici
Generalmente, l’energia verrà rilasciata quando si forma un legame tra due atomi, indipendentemente dal tipo di legame. Allo stesso modo, se esiste già un legame tra due atomi, sarà necessaria energia per romperlo. La quantità di energia necessaria per rompere un legame è la stessa della quantità di energia rilasciata quando si forma.
La maggior parte delle reazioni chimiche comporta sia la rottura che la creazione di legami chimici. Se l’energia rilasciata formando nuovi legami è maggiore dell’energia necessaria per rompere i legami “vecchi”, l’energia verrà rilasciata complessivamente dalla reazione. Questa energia può essere persa come calore o può essere utilizzata per l’alimentazione.
Ad esempio, la combustione del metano (CH4) segue questa reazione chimica:
Questa reazione comporta la rottura dei quattro legami carbonio-idrogeno nel metano e del legame ossigeno-ossigeno in O2. Nuovi legami formati sono i due legami carbonio-ossigeno (in CO2) e legami idrogeno-ossigeno (in H2O). Questi nuovi legami hanno meno energia complessiva rispetto ai legami originali, quindi l’energia verrà rilasciata da questa reazione. Il rilascio di energia è una caratteristica delle reazioni di combustione – potresti averlo notato quando senti una fiamma calda. L’animazione seguente illustra la combustione di idrocarburi del metano.
Poiché una grande quantità di energia viene rilasciata quando si forma la CO2 e l’H2O nella combustione di idrocarburi come il metano, questi sono una buona fonte di energia primaria. Significa anche che una grande quantità di energia sarebbe necessaria per rompere i legami in CO2 e formare altre molecole. Questo è uno dei motivi per cui la fotosintesi richiede tanta energia (dalla luce solare) per convertire la CO2 in carboidrati.
Per ulteriori letture
- Energia chimica
- Combustione
- Energia primaria
- Tecnologia di conversione dell’energia
- O esplorare una pagina casuale
Leave a Reply