Idrossido di sodio
Idrossido di sodio Proprietà chimiche, usi, produzione
Proprietà chimiche
L’idrossido di sodio è un materiale alcalino bianco, inodore, non volatile commercializzato in forma solida come pellet, fiocchi, grumi o bastoncini. La sua solubilità in acqua è del 111% in peso e una pressione di vapore di 0 mmHg (NIOSH, 1994).
Può reagire con tricholoethylene (TCE) per formare dicloroacetilene infiammabile e con metalli per formare gas idrogeno (OEHHA, 1993). La sua reattività con i metalli dovrebbe essere considerata per quanto riguarda le unità di stoccaggio e i contenitori.
L’idrossido di sodio è comunemente disponibile come soluzione acquosa nota come soda caustica, soda liscivia o semplice come liscivia. Ha vari usi, compresa la neutralizzazione dell’acido; la fabbricazione di carta, tessuti, materie plastiche, corrosivi, coloranti, vernici, svernicianti e sapone; raffinazione del petrolio; galvanotecnica; pulizia dei metalli; riciclaggio; e lavaggio dei piatti. Un uso fiorente è stato nella produzione illegale di metanfetamina.
Usi
L’idrossido di sodio (NaOH) è uno dei composti di sodio industriali più utili. È anche conosciuto come liscivia o soda caustica ed è uno dei più forti alcali di base (alto valore di pH)sul mercato domestico. È usato come pulitore del forno e dello scolo e saponifica i grassi in themanufacture di sapone. Deve essere usato con cura perché è anche in grado di produrre gravi bruciature della pelle.
Descrizione
L’idrossido di sodio, noto anche come liscivia e soda caustica, è una sostanza altamente caustica che viene utilizzata in piccole quantità nei cosmetici per stabilire e mantenere il pH di un prodotto.L’idrossido di sodio è un composto estremamente importante nelle nostre vite perché ha così tanti usi. È una base molto comune utilizzata nell’industria chimica e viene utilizzata per molte cose, molte delle quali si verificano nella nostra vita quotidiana. Uno degli usi più noti di idrossido di sodio è il suo uso in scarichi unclogging. Viene in molte marche diverse di pulitori di scarico, ma uno dei più comuni è Drano. Si presenta anche sotto forma di sapone liscivia che può essere utilizzato per lavare praticamente qualsiasi cosa, dai piatti al viso.
struttura idrossido di sodio
A temperatura ambiente, l’idrossido di sodio è un solido inodore cristallino bianco che assorbe l’umidità dall’aria. È una sostanza fabbricata. L’idrossido di sodio è un composto inorganico utilizzato per controllare i livelli di pH o servire come agente tampone nei cosmetici e nei prodotti per la cura personale. E ‘ stato storicamente utilizzato nella formulazione di saponi, ma è attualmente visto in una varietà di formule, tra cui prodotti da bagno, prodotti per la pulizia, profumi, polveri del piede, tinture per capelli e colori, trucco, prodotti per le unghie, prodotti per la pulizia personale, shampoo, prodotti per la rasatura, depilatori, prodotti per la cura della pelle e prodotti per l’abbronzatura, È anche un ingrediente popolare nei solventi industriali come base chimica per saponi, detergenti per forni, detergenti e detergenti per scarico a causa della sua capacità di sciogliere grassi, oli, grassi e depositi a base di proteine, secondo Wikipedia. Meno frequentemente, l’idrossido di sodio è visto come ingrediente nei dentifrici.
L’idrossido di sodio è approvato dalla FDA e ha ricevuto la valutazione GRAS (generalmente riconosciuta come sicura) come additivo alimentare diretto. Tuttavia, viene utilizzato principalmente nel lavaggio e nel peeling chimico dei prodotti. È approvato per l’uso in cosmetici e prodotti per la cura personale in diverse concentrazioni: 5% in peso nei solventi per cuticole per unghie, 2% in peso nelle piastre per capelli per uso generale, 4,5% in peso nelle piastre per capelli per uso professionale, fino a un pH 12,7 nei depilatori e fino a pH 11 in altri usi come
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
Proprietà chimiche
L’idrossido di sodio, NaOH,noto anche come soda caustica o idrato di sodio(e precedentemente noto come liscivia), è un solido cristallino bianco,massiccio e deliquescente solubile in acqua, alcool e glicerolo. Si scioglie a 318°C (606 DI) ed è la sostanza chimica alcalina più utilizzata e disponibile. La maggior parte dell’idrossido di sodio è prodotta come coprodotto di cloro attraverso l’uso di cellule elettrolitiche; le cellule sono del diaframma, del mercurio o del tipo di membrana. Alcuni idrossido di sodio è contrassegnato come prodotto nelle cellule; la maggior parte è evaporata e venduta come soluzioni 50% e 73% o come perline anidre. La maggior parte degli usi finali caustici richiedono soluzioni di concentrazioni relativamente basse. La soda caustica è utilizzata come reagente analitico e intermedio chimico, nei bagni di pulizia e pulizia, nel recupero della gomma e nella raffinazione del petrolio,nei bagni di tempra per il trattamento termico dell’acciaio,nel taglio e negli oli solubili, nei saponi e nei detergenti e in un’ampia varietà di altre applicazioni.
Proprietà chimiche
NaOH è un materiale bianco, inodore, deliquescente venduto come pellet, fiocchi, grumi o bastoncini. Le soluzioni acquose sono conosciute come soda liscivia
Proprietà chimiche
L’idrossido di sodio si presenta come una massa fusa bianca o quasi bianca. Isavailable in piccole palline, fiocchi, bastoni ed altre forme o forme. È duro e fragile e mostra una frattura cristallina. L’idrossido di sodio è molto deliquescente e all’esposizione all’aria assorbe rapidamente anidride carbonica e acqua.
proprietà Fisiche
Bianco ortorombico cristalli, prodotto in forma di pellets, grumi, bastoni, perline, trucioli, scaglie o soluzioni; igroscopico; molto corrosivo; rapidamente assorbe la CO2 e l’acqua dall’aria; densità 2,13 g/cm3; fonde a 323°C; vaporizza 1388°C; pressione di vapore di 1 torr a 739°C e 5 torr a 843°C; molto solubile in acqua (110 g/100mL a temperatura ambiente), la generazione di calore in sede di liquidazione; soluzioni acquose altamente alcalino, pH di 0,5% soluzione di circa il 13 e 0,05% soluzione di circa 12; solubile in metanolo, etanolo e glicerolo (23.8 g/100 mL di metanolo e 13.9 g / 100 ml di etanolo a temperatura ambiente.).
Usi
Soda caustica è uno dei più ampiamente usedchemicals. È usato per neutralizzare gli acidi; sali di sodio di tomake; per precipitare i metalli come i loro idrossidi; nella raffinazione del petrolio; nel thesaponification degli esteri; nel trattamento ofcellulose, plastica e gomma; e in numeroussynthetic e applicazioni analitiche.
Usi
L’idrossido di sodio è venduto commercialmente come fiocchi o pellet anidri o come soluzioni acquose al 50% o al 73%. Ha innumerevoli usi industriali ed è uno dei primi 10 chimici in termini di produzione e utilizzo su scala globale. Circa 15 milioni di tonnellate di idrossido di sodio vengono utilizzate ogni anno. Il suo uso più grande, consumando circa la metà della sua produzione, è come base nella produzione di altri prodotti chimici. È usato per controllare il pH e neutralizzare gli acidi nei processi chimici. L’industria della carta fa ampio uso di idossido di sodio nel processo di spappolamento. L’idrossido di sodio viene utilizzato per separare le fibre sciogliendo la lignina di collegamento. Viene utilizzato in modo simile nella produzione di rayon dalla cellulosa. L’idrossido di sodio è una sostanza chimica chiave nel sapone industry.In il processo di saponificazione, i trigliceridi ottenuti da animali e piante vengono riscaldati in soluzione abasica per dare glicerolo e sapone:
L’idrossido di sodio è utilizzato nell’industria tessile per lo sbiancamento e il trattamento dei tessuti per renderli più facilmente coloranti. L’industria petrolifera utilizza idrossido di sodio nei fanghi di perforazione e nel battericida asa. L’ipoclorito di sodio (NaOCl) è ampiamente utilizzato per la pulizia e come disinfettante.La candeggina domestica comune è costituita da circa il 5% di soluzione di ipoclorito di sodio. Il sodiumipoclorito viene preparato facendo reagire il cloro con idrossido di sodio: Cl2(g) + 2NaOH(aq) →NaOCl(aq) + NaCl(aq) + H2O(l). L’idrossido di sodio è utilizzato nell’industria alimentare per la puliziae sbucciare frutta e verdura. L’idrossido di sodio è un ingrediente minore in molti comuniprodotti domestici, ma in pochi può costituire più della metà del prodotto. I dranocristalli contengono tra il 30% e il 60% di idrossido di sodio e alcuni detergenti di scarico possono consistof 100% di idrossido di sodio.
Usi
L’idrossido di sodio è un alcali solubile in acqua, con una solubilità di 1 g in 1 ml di acqua. è usato per distruggere le sostanze chimiche amare nelle olive che diventeranno olive nere. funziona anche per neutralizzare gli acidi in vari prodotti alimentari.
Usi
l’idrossido di sodio viene utilizzato per regolare il pH di un prodotto per renderlo più accettabile per la pelle. È comunemente indicato come soda caustica e spesso serve come reagente chimico quando si fa il sapone. Se troppo concentrato può causare gravi irritazioni cutanee.
Usi
L’idrossido di sodio è uno dei prodotti chimici industriali più importanti. In volume, è tra i primi dieci prodotti chimici prodotti negli Stati Uniti. Viene utilizzato nella produzione di un gran numero di composti tra cui diversi sali di sodio, nel trattamento della cellulosa per la produzione di rayon e cellophane e nella produzione di saponi, detergenti, pasta e carta. L’idrossido di sodio è un agente neutralizzante comune per gli acidi nelle titolazioni acido-base e nella raffinazione del petrolio. Un’altra importante applicazione è l’estrazione di metalli dai loro minerali dove la fusione alcalina, come la fusione con soda caustica, viene spesso applicata per aprire i minerali. Inoltre, l’idrossido di sodio viene utilizzato per precipitare i metalli come idrossidi. Altri usi sono nel recupero della gomma, nella dissoluzione della caseina nella produzione di materie plastiche, nella raffinazione di oli vegetali, nella lavorazione di tessuti, come eluente nella cromatografia ionica, nell’incisione e nella placcatura elettrolitica e come reagente di laboratorio. L’idrossido di sodio è anche usato come base forte in molte reazioni di sintesi organica e catalizzate dalla base.
Usi
Le soluzioni NaOH sono utilizzate per neutralizzare gli acidi e produrre sali di sodio, ad esempio nella raffinazione del petrolio per rimuovere gli acidi solforici e organici; per trattare la cellulosa nella produzione di rayon viscosa e cellophane; nel recupero della gomma per sciogliere il tessuto; nella produzione di materie plastiche per sciogliere la caseina. Le soluzioni di NaOH idrolizzano i grassi e formano saponi; precipitano alcaloidi (basi) e la maggior parte dei metalli (come idrossidi) dalle soluzioni acquose dei loro sali. Aiuto farmacologico (alkalizer).
Preparazione
L’idrossido di sodio viene prodotto insieme al cloro mediante elettrolisi della soluzione di cloruro di sodio. Vari tipi di celle elettrolitiche sono usati commercialmente. Includono la cellula di mercurio, la cellula del diaframma e la cellula della membrana.
Una soluzione satura di salamoia viene elettrolizzata. Il gas di cloro viene liberato all’anodo e lo sodium sodio al catodo. La decomposizione dell’acqua produce ioni idrogeno e idrossido. Lo combines idrossido si combina con lo ion sodio formando NaOH. Le reazioni elettrolitiche complessive possono essere rappresentate come:
2Na+ + 2Cl – + 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
La cellula di mercurio procede in due fasi che si verificano separatamente in due cellule. Il primo è conosciuto come la cella di salamoia o l’elettrolizzatore primario in cui lo sodium di sodio si deposita sul catodo di mercurio formando amalgama, mentre il gas di cloro viene liberato all’anodo:
Na+ + Cl–→ Na-Hg (catodo) + ½Cl2(g) (anodo)
Nella seconda cella, nota come cellula decompositrice, viene utilizzato un catodo di grafite mentre l’amalgama di sodio funge da anodo. L’acqua reagisce con il metallo di sodio dell’amalgama nel decompositore:
Na-Hg + H2O → Na+ + OH– + ½H2 + Hg
Nelle cellule del diaframma cloro-alcali, un diaframma viene impiegato per separare il cloro liberato all’anodo dall’idrossido di sodio e dall’idrogeno generato al catodo. Senza un diaframma, l’idrossido di sodio formato si combinerà con il cloro per formare ipoclorito di sodio e clorato. In molte cellule, i diaframmi di amianto vengono utilizzati per tale separazione. Sono disponibili molti tipi di celle a diaframma.
L’idrossido di sodio è prodotto come solido anidro o come soluzione acquosa al 50%.
Definizione
Il più importante commercialcaustic.
Metodi di produzione
L’idrossido di sodio è prodotto per elettrolisi di salamoia utilizzando elettrodi inerti. Il cloro si è evoluto come un gas all’anodo e l’idrogeno si è evoluto come un gas al catodo. La rimozione di cloridee ioni idrogeno lascia ioni sodio e idrossido in soluzione.La soluzione viene essiccata per produrre l’idrossido di sodio solido.
Un secondo metodo utilizza la cella di Kellner–Solvay. La soluzione satura del sodiumchloride è elettrolizzata fra un anodo del carbonio ed il catodo aflowing del mercurio. In questo caso il sodio è prodotto al thecathode piuttosto che l’idrogeno a causa della disponibilità ofsodium per dissolversi nel mercurio. L’amalgama sodio–mercurio è quindi esposto all’acqua e viene prodotta una soluzione di idrossido di sodio.
Reazioni
L’idrossido di sodio è fortemente alcalino e può reagire con gli acidi per formare sali e acqua.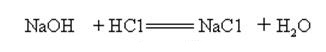
L’idrossido di sodio reagisce con ossidi acidi per formare sale e acqua, quindi l’idrossido di sodio può essere usato per assorbire gas acidi in laboratorio o industrialmente.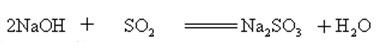
idrossido di Sodio in grado di reagire con soluzioni acquose di molti sali di metallo a forma di sali di sodio e idrossidi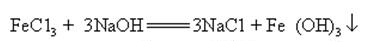
Quando idrossido di sodio e ammoniaca sale riscaldate insieme, si può liberare ammoniaca 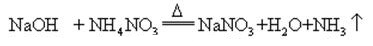
l’idrossido di Sodio è altamente corrosivo, in modo che le bottiglie di vetro memorizzazione di idrossido di sodio, soluzioni devono essere tappi di gomma e tappi di vetro non dovrebbe essere usato per prevenire una reazione chimica di apertura. L’idrossido di sodio è un’importante materia prima industriale e può essere prodotto per elettrolisi di soluzione salina industrialmente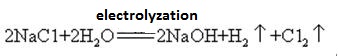
Descrizione generale
Un solido bianco. Corrosivo per metalli e tessuti. Utilizzato nella produzione chimica, raffinazione del petrolio, composti di pulizia, detergenti di scarico.
Aria & Reazioni acquose
Solubile in acqua. La dissoluzione può liberare abbastanza calore per causare vapore e schizzi e accendere il materiale combustibile adiacente .
Profilo di reattività
LA SODA CAUSTICA (idrossido di sodio) è una base forte. Reagisce rapidamente ed esotermicamente con acidi, sia organici che inorganici. Assorbe facilmente l’umidità dall’aria per dare semi-solidi caustici che attaccano l’alluminio e lo zinco con l’evoluzione del gas idrogeno infiammabile. Catalizza la polimerizzazione dell’acetaldeide e di altri composti polimerizzabili; queste reazioni possono verificarsi violentemente, ad esempio, l’acroleina polimerizza con estrema violenza quando viene messa a contatto con materiali alcalini come l’idrossido di sodio . Reagisce con grande violenza con il pentaossido di fosforo quando avviato dal riscaldamento locale . Il contatto (come agente essiccante) con tetraidrofurano, che spesso contiene perossidi, può essere pericoloso—esplosioni si sono verificate in un tale uso dell’idrossido di potassio chimicamente simile . La miscelazione con una qualsiasi delle seguenti sostanze in un contenitore chiuso ha causato l’aumento della temperatura e della pressione: acido acetico glaciale, anidride acetica, acroleina, cloroidrina, acido clorosolfonico, etilene cianoidrina, gliossale, acido cloridrico (36%), acido fluoridrico (48,7%), acido nitrico (70%), oleum, propiolattone, acido solforico (96%) . Il contatto accidentale tra una soluzione detergente caustica (probabilmente contenente idrossido di sodio) e Pentol ha causato una violenta esplosione. . Il riscaldamento con una miscela di alcool metilico e triclorobenzene durante un tentativo di sintesi ha portato ad un improvviso aumento della pressione e ad un’esplosione . NaOH caldo e / o concentrato può causare la decomposizione esotermica dell’idrochinone a temperatura elevata. (NFPA Pub. 491M, 1975, 385)
Pericolo
Corrosivo per i tessuti in presenza di umidità, forte irritante per i tessuti (occhi, pelle, membrane mucose e vie respiratorie superiori), veleno da digestione.
Pericolo per la salute
Forte azione corrosiva sui tessuti contattati. INALAZIONE: la polvere può causare danni alle vie respiratorie superiori e ai polmoni stessi, producendo da lieve irritazione del naso a polmonite. INGESTIONE: grave danno alle mucose; può verificarsi grave formazione di cicatrici o perforazione. CONTATTO CON GLI OCCHI: produce gravi danni.
Pericolo per la salute
L’idrossido di sodio è una sostanza altamente corrosiva che causa danni ai tessuti umani.La sua azione sulla pelle è in qualche modo diversadalle ustioni acide. Non c’è dolore immediato,ma penetra nella pelle. Non coagulateproteina per impedire la sua ulteriore penetrazione, e quindi l’ustione caustica può diventare grave e lenta guarigione. La fuoriuscita delle sue soluzioni concentrate negli occhi può causare gravi irritazioni o lesioni permanenti.
È tossico per ingestione e inalazionedella sua polvere. Sebbene la tossicità orale di una soluzione al 5-10% di soda caustica sia stata riscontrata bassa negli animali di prova, alti dosaggi a concentrazioni più elevate possono causare vomito,prostrazione e collasso. La dose letale orale nei conigli è di 500 mg / kg (NIOSH 1986).
Le polveri di idrossido di sodio o gli aerosol sono irritanti per gli occhi, il naso e la gola. Prolungatoesposizione ad alte concentrazioni nell’ariapuò produrre ulcerazione del passaggio nasale.
Pericolo di incendio
Non combustibile, la sostanza stessa non brucia ma può decomporsi al riscaldamento per produrre fumi corrosivi e / o tossici. Alcuni sono ossidanti e possono accendere combustibili (legno, carta, olio, abbigliamento, ecc.). Il contatto con i metalli può evolvere gas idrogeno infiammabile. I contenitori possono esplodere quando riscaldati.
Infiammabilità ed esplosibilità
L’idrossido di sodio e l’idrossido di potassio non sono infiammabili come solidi o soluzioni acquose.
Applicazioni farmaceutiche
L’idrossido di sodio è ampiamente usato nelle formulazioni farmaceutiche per regolare il pH delle soluzioni. Può anche essere usato per reagire con deboleacidi per formare sali.
Usi industriali
La soda caustica (NaOH) è considerata il più forte regolatore di pH alcalino. Soda causticaè una sostanza molto attiva ed è altamente corrosiva. Viene prodotta la maggior parte della soda causticaper elettrolisi di salamoie sature (NaCl). La soda caustica ha una capacità di regolazione molto forte (cioè da pH 7 a pH 14) a un dosaggio relativamente basso rispetto ad altre sostanze alcaline. Commercialmente, la soda caustica è disponibile in forma anidra, ma nella maggior parte delle applicazioni minerarie la soda caustica viene fornita come soluzione al 50%.
Nell’industria di trasformazione dei minerali, l’idrossido di sodio è utilizzato principalmente per il controllo dell’alcalinità durante la lavorazione di minerali non metallici. Nella flottazione del metallo base, l’uso diidrossido di sodio è raro.
Profilo di sicurezza
Veleno per via intraperitoneale. Moderatamente tossico per ingestione. Dati di mutazione riportati. Irritante corrosivo per la pelle, gli occhi e le mucose. Quando riscaldato alla decomposizione emette fumi tossici di NanO.
Sicurezza
L’idrossido di sodio è ampiamente utilizzato nelle industrie farmaceutiche e alimentari ed è generalmente considerato un materiale non tossico a basse concentrazioni. Ad alte concentrazioni è un irritante corrosivola pelle, gli occhi e le mucose.
LD50 (mouse, IP): 0.04 g/kg
LD50 (coniglio, orale): 0.5 g / kg
Esposizione potenziale
NaOH è utilizzato per neutralizzare gli acidi e fare sali di sodio nella raffinazione del petrolio, viscosa rayon; cellophane, produzione di plastica; e nella bonifica di soluzioni dei loro sali. Viene utilizzato nella produzione di cotone mercerizzato, carta, esplosivi e coloranti nella pulizia dei metalli; estrazione elettrolitica dello zinco; stagnatura; rivestimento di ossido; riciclaggio, sbiancamento, lavaggio dei piatti; ed è utilizzato nelle industrie chimiche.
conservazione
gli spruzzi e i guanti impermeabili devono essere indossati in ogni momento durante la manipolazione di queste sostanze per evitare il contatto con gli occhi e la pelle. Le operazioni con idrossidi metallici che hanno il potenziale per creare aerosol devono essere condotte in una fumosità per prevenire l’esposizione per inalazione. NaOH e KOH generano notevole heatwhen disciolto in acqua; quando si mescola con acqua, sempre aggiungere caustiche lentamente per thewater e mescolare continuamente. Non aggiungere mai acqua in quantità limitate al solidoidrossidi. I contenitori di idrossidi devono essere conservati in un luogo fresco e asciutto, separati da acidi e sostanze incompatibili.
conservazione
L’idrossido di sodio deve essere conservato in un contenitore ermetico non metallico in un luogo fresco e asciutto. Quando esposto all’aria, l’idrossido di sodio assorbe rapidamente l’umidità e si liquefa, ma successivamente diventa nuovamente solido a causa dell’assorbimento dell’anidride carbonica e della formazione del carbonato di sodio.
Spedizione
UN1823 NaOH, solido, Classe di pericolo: 8; Etichette: 8-Materiale corrosivo. UN1824 NaOH, soluzione, Classe di pericolo: 8; Etichette: 8-Materiale corrosivo
Metodi di purificazione
Le impurità comuni sono acqua e carbonato di sodio. L’idrossido di sodio può essere purificato sciogliendo 100g in 1L di EtOH puro, filtrando la soluzione sotto vuoto attraverso un disco di vetro sinterizzato fine per rimuovere carbonati e alogenuri insolubili. (Questa e le successive operazioni devono essere eseguite in una scatola asciutta e priva di CO2.) La soluzione viene concentrata sotto vuoto, utilizzando un leggero riscaldamento, per dare una sospensione spessa del monoalcolato che viene trasferito su un disco di vetro sinterizzato grossolano ed evacuato privo di liquore madre. Dopo aver lavato i cristalli più volte con alcool purificato per rimuovere tracce di acqua, vengono essiccati sotto vuoto, con riscaldamento delicato, per circa 30 ore per decomporre l’alcolato, lasciando una polvere cristallina bianca fine . CAUSTICO. Soluzioni di idrossido di sodio (caustico), 14.77. Lo Carbonate carbonato può essere rimosso passando attraverso una colonna di scambio anionico (come Amberlite IRA-400; OH form form). La colonna deve essere preparata al momento dalla forma di cloruro mediante lento passaggio preliminare della soluzione di idrossido di sodio fino a quando l’effluente non fornisce alcuna prova per gli ioni cloruro. Dopo l’uso, la colonna può essere rigenerata lavando con HCL diluito, quindi con acqua. Allo stesso modo, altri ioni metallici vengono rimossi quando una soluzione di NaOH 1M (o più diluita) viene fatta passare attraverso una colonna di resina A-1 a scambio ionico Dowex nella sua forma Na+. In alternativa, la contaminazione da carbonato può essere ridotta risciacquando rapidamente i bastoncini di NaOH (qualità del reagente analitico) con H2O, quindi sciogliendoli in H2O distillato, o preparando una soluzione acquosa concentrata di NaOH e prelevando il liquido surnatante chiaro. (Na2CO3 insolubile è lasciato alle spalle.) La contaminazione da carbonato può essere ridotta aggiungendo un leggero eccesso di BaCl2 concentrato o Ba(OH)2 ad una soluzione di NaOH, agitando bene e permettendo al precipitato BaCO3 di depositarsi. Se la presenza di Ba nella soluzione è inaccettabile, è possibile utilizzare una purificazione elettrolitica. Ad esempio, l’amalgama di sodio viene preparato mediante elettrolisi di 3L di NaOH al 30% con 500 ml di mercurio puro per catodo e un anodo di platino, passando 15 Faradays a 4Amps, in una bottiglia di polietilene a pareti spesse. La bottiglia è quindi dotata di tubi di ingresso e di uscita, la soluzione esaurita viene lavata con N2 privo di CO2. L’amalgama viene quindi lavato accuratamente con un grande volume di acqua deionizzata (con la corrente di elettrolisi attivata per ridurre al minimo la perdita di Na). Infine, una barra di acciaio pulita viene posta a contatto nella soluzione con l’amalgama (per facilitare l’evoluzione dell’idrogeno), la reazione viene lasciata procedere fino a raggiungere una concentrazione adeguata, prima di essere trasferita in un recipiente di stoccaggio e diluita come richiesto .
Incompatibilità
Una base forte e un forte ossidante. Reazione violenta con acido. Incompatibile con acqua; liquidi infiammabili; alogeni organici, nitrometano e nitrocomposti, combustibili. Assorbe rapidamente anidride carbonica e acqua dall’aria. Il contatto con l’umidità o l’acqua può generare calore. Corrosivo per i metalli. Contatto con zinco, alluminio, stagno e piombo in presenza di umidità, formando gas idrogeno esplosivo. Attacca alcune forme di plastica, gomma o rivestimenti.
Incompatibilità
L’idrossido di sodio è una base forte ed è incompatibile con qualsiasi composto che subisce prontamente idrolisi o ossidazione. Reagirà con acidi, esteri ed eteri, specialmente in soluzione acquosa.
Smaltimento dei rifiuti
Scaricare nel serbatoio contenente acqua, neutralizzare, quindi scaricare nella fogna con acqua.
Stato normativo
GRAS elencato. Accettato per l’uso come additivo alimentare in Europa.Incluso nel database degli ingredienti inattivi FDA (preparati dentali; iniezioni; inalazioni; preparazioni nasali, oftalmiche, orali, otiche,rettali, topiche e vaginali). Incluso in medicinali non parenterali e parenterali autorizzati nel Regno Unito. Incluso nelelenco canadese di ingredienti non medicinali accettabili.
Leave a Reply