Gestione degli stravasi chemioterapici
US Pharm. 2009;34 (9) (Oncology suppl): 3-11.
ABSTRACT: I farmaci chemioterapici per via endovenosa (IV) hanno il potenziale di causare lesioni da stravaso o necrosi tissutale nel sito di somministrazione. Sebbene la maggior parte degli stravasi possa essere prevenuta con una corretta e accurata somministrazione per infusione, diversi antidoti sono stati riconosciuti e studiati per prevenire ulteriori lesioni tissutali.
L’infiltrazione e lo stravaso sono due ben note e distinte complicanze della terapia per infusione endovenosa. Secondo la Infusion Nurses Society e la Oncology Nursing Society, entrambe le complicazioni comportano la perdita involontaria di una soluzione IV nel tessuto circostante; tuttavia, il tipo di soluzione differisce. L’infiltrazione è la somministrazione involontaria di una soluzione o di un farmaco non irritante o irritante nei tessuti circostanti.1,2 I nonvesicanti sono agenti che raramente producono reazioni acute o distruggono il tessuto quando si infiltrano. Gli agenti irritanti possono indurre dolore al sito di iniezione o lungo la vena, con o senza una reazione infiammatoria, di solito senza danni tissutali persistenti. Tuttavia, le sostanze irritanti possono causare ulcere dei tessuti molli solo se una grande quantità di soluzione di farmaco concentrata viene inavvertitamente stravasata per indurre reazioni infiammatorie senza danni tissutali persistenti.3,4
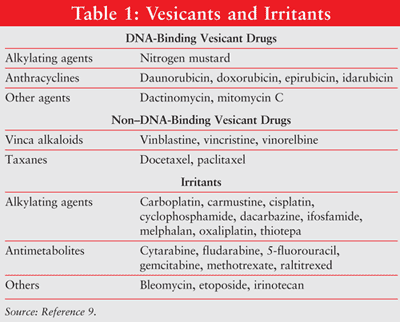
Lo stravaso si riferisce all’instillazione involontaria o alla fuoriuscita di materiale vescicante negli spazi perivascolari e sottocutanei durante la somministrazione del farmaco.1,2 Lo stravaso provoca reazioni locali che vanno dall’irritazione locale alla grave necrosi tissutale della pelle, del sistema vascolare circostante e delle strutture di supporto.5-8 Agenti chemioterapici possono essere classificati, in base al loro potenziale di causare lesioni tissutali locali, come vescicanti, irritanti o nonvesicanti. (Diversi vescicanti e irritanti sono descritti nella TABELLA 1.9) Lo stravaso accidentale di farmaci per via endovenosa si verifica in circa lo 0,1% al 6% delle infusioni per via endovenosa periferiche e lo 0,3% al 4,7% delle infusioni di porta di accesso venoso impiantate.10-12
Fisiopatologia del danno tissutale
L’entità del danno tissutale dipende dalla capacità di legame dell’agente chemioterapico al DNA. Gli agenti leganti il DNA includono antracicline, antibiotici antitumorali, analoghi del platino e alcuni agenti alchilanti.3,4 Gli antineoplastici leganti il DNA causano danni ai tessuti propagando letali reticolature del DNA o rotture di filamenti causate dai radicali liberi, che portano all’apoptosi cellulare.13-17 Antineoplastici non leganti il DNA (ad es., alcaloidi della vinca, taxani, inibitori della topoisomerasi) interferiscono con la mitosi. Gli agenti non leganti il DNA vengono eliminati più facilmente dai siti di stravaso e causano meno danni ai tessuti rispetto agli agenti leganti il DNA.17
Fattori di rischio per lo stravaso
I rischi per lo stravaso sono multifattoriali e sono ampiamente modificabili. Molti di questi rischi derivano da errori nell’uso e nel posizionamento del dispositivo. I fattori del dispositivo IV che influenzano il rischio di stravaso includono il materiale dell’ago (cioè metallo), la dimensione della cannula (plastica grande contro plastica piccola) e il tipo di catetere (cioè catetere venoso centrale). Gli aghi metallici possono causare più danni all’inserimento e sono inflessibili all’interno del recipiente, mentre gli aghi di grosso calibro possono impedire il flusso sanguigno, rallentando la diluizione dell’infusato.18,19 Lo stravaso da CVCS può verificarsi con spostamento dell’ago da una porta di accesso venoso impiantata (IVAP), occlusione meccanica e conseguente danno CVC, migrazione del catetere o formazione di maniche di fibrina e trombosi. Il posizionamento errato di IVAP è più probabile che si verifichi in pazienti con nuovi dispositivi, quelli con gonfiore postoperatorio significativo e pazienti obesi o donne dal petto grande.20 Occlusioni meccaniche possono essere dovute a formazione di trombi, precipitati da farmaci, spostamento retrogrado del catetere o pizzicamento (ad esempio, occlusione intermittente e posizionale del catetere; si deve sospettare che l’occlusione dell’infusione possa essere alleviata facendo muovere il paziente in posizione del braccio).2,21,22 Evitare lo stravaso dipende in larga misura dal corretto mantenimento del sito endovenoso e dalla corretta velocità di infusione. Questi fattori di rischio sono correlati agli antineoplastici utilizzati, ai pazienti e al clinico che somministra il farmaco.
Prevenzione
Uno stretto monitoraggio dei pazienti e l’educazione sia dei pazienti che degli operatori sui rischi e sulla gestione dello stravaso vescicante sembrano essere i capisaldi della prevenzione. Mentre i medici hanno la responsabilità di scrivere ordini accurati, gli infermieri sono responsabili di garantire il posizionamento qualificato e corretto dei dispositivi e il monitoraggio delle infusioni di chemioterapia visivamente e attraverso le interviste ai pazienti. Durante la somministrazione di vescicante, il sito deve essere monitorato per gonfiore, arrossamento e dolore. I vescicanti devono essere somministrati in conformità alle raccomandazioni del produttore (ad esempio, diluizione adeguata, tempo di somministrazione specificato). Le linee IV devono essere lavate prima e dopo la somministrazione della chemioterapia. Il ruolo del farmacista sarebbe quello di aiutare a sviluppare politiche che garantiscano la corretta verifica, etichettatura e erogazione di agenti chemioterapici. Un modo in cui questo potrebbe essere eseguito è quello di utilizzare l’etichettatura discriminativa quando si dispensano antineoplastici vescicanti in modo che gli infermieri utilizzino le opportune misure precauzionali. I farmacisti possono svolgere un ruolo fondamentale nell’educazione fornendo informazioni sui farmaci e servizi di routine a tutti i membri del team sanitario sull’uso e la somministrazione corretti dei vari agenti chemioterapici. Occorre adottare un approccio collaborativo multidisciplinare per garantire l’attuazione di pratiche sicure. La somministrazione della chemioterapia nei pazienti richiede la corretta formazione del personale e l’educazione dei pazienti e il supporto amministrativo attraverso l’attuazione della politica.2,23
Documentazione degli eventi
Ogni incidente di stravaso deve essere accuratamente documentato e segnalato. La documentazione serve a diversi scopi, tra cui fornire un resoconto accurato di ciò che è accaduto, proteggere gli operatori sanitari coinvolti, raccogliere informazioni sugli stravasi e evidenziare i deficit nella pratica.23 La documentazione e la segnalazione alle entità appropriate delle reazioni avverse ai farmaci e degli errori dei farmaci è un altro modo in cui i farmacisti possono aiutare a prevenire eventi futuri. I dati raccolti dalle reazioni avverse riportate e dagli errori dei farmaci potrebbero essere utilizzati come strumenti di apprendimento per esaminare sistematicamente i mezzi con cui si verificano questi eventi. Le procedure e i protocolli locali sono fondamentali per il riconoscimento e la gestione tempestivi dello stravaso e la prevenzione di gravi danni ai tessuti. Dovrebbero essere fatti sforzi di collaborazione per garantire tempestivi tentativi multidisciplinari di educare tutti i membri del team di assistenza sanitaria coinvolti nella gestione di questi pazienti una volta che si è verificato l’evento. Si dovrebbero compiere ulteriori sforzi per avviare politiche che impediscano ulteriori eventi. Se le politiche sono in atto, dovrebbero essere rese prontamente disponibili e aggiornate regolarmente per riflettere le pratiche attuali. La European Oncology Nursing Society (EONS) 2007 linee guida extravasation forniscono dati suggeriti e modelli che possono essere utilizzati per raccogliere informazioni in caso di un caso.Segni e sintomi di stravaso Segni e sintomi di stravaso
Segni e sintomi di stravaso vescicante includono gonfiore, arrossamento e / o fastidio che sono spesso descritti come bruciore o bruciore. Resistenza durante la somministrazione del farmaco, un’infusione lenta o lenta e la mancanza o la perdita di ritorno del sangue dalla cannula IV, dalla porta impiantata o da un altro dispositivo di accesso venoso centrale possono essere indicatori che si sta verificando uno stravaso vescicante.23 Lo scolorimento e le indurimenti della pelle possono progredire ulteriormente con lo sviluppo di vesciche o necrosi e possibilmente ulcerazioni e lesioni profonde dei tessuti. Potrebbero essere necessari diversi giorni per la piena estensione del danno epiteliale da realizzare.
Trattamento dello stravaso indotto dalla chemioterapia
Le modalità di trattamento utilizzate per la gestione dello stravaso vescicante comprendono l’interruzione immediata della chemioterapia e il raffreddamento o la diluizione del sito di stravaso. Per ridurre la morbilità associata allo stravaso, è fondamentale che i medici siano ben informati sui trattamenti disponibili e lavorino rapidamente per evitare ulteriori danni al paziente. La gestione di stravaso nonvesicant comprende tipicamente elevando l’arto ed il raffreddamento e non comprende solitamente l’uso della terapia farmacologica.23
La gestione iniziale dello stravaso vescicante
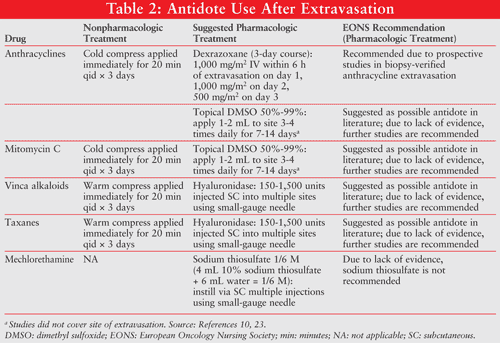
La facilità di intervento precoce può essere facilitata mettendo a disposizione un kit di stravaso all’interno dell’istituto. La maggior parte dei kit di stravaso contiene siringhe e cannule monouso, confezioni a caldo freddo, garze, cerotto adesivo, guanti sterili e protettivi e farmaci per trattare lo stravaso (ad esempio, ialuronidasi, dimetilsolfossido 99%, dexrazoxano). Un elenco dei contenuti del kit deve essere inserito all’interno del kit e la verifica regolare del contenuto del farmaco con date di scadenza aggiornate deve essere mantenuta regolarmente da un farmacista.2
Una volta che si verifica uno stravaso del vescicante, il medico deve interrompere immediatamente l’infusione; tuttavia, la cannula o l’ago della porta non perforante devono essere tenuti in posizione e si deve tentare di aspirare il vescicante con una siringa da 10 mL. L’area di stravaso deve essere contrassegnata e fotografata; quindi la cannula o l’ago devono essere rimossi e il medico deve essere informato. I pazienti possono richiedere l’uso di analgesici per aiutare a gestire il dolore che possono sperimentare. Una volta che sono state adottate le misure iniziali, è molto importante documentare accuratamente la reazione avversa al farmaco e / o l’errore del farmaco che si è verificato.23
Per gli alcaloidi della vinca, dove è indicata la dispersione o la diluizione del vescicante, applicare calore locale per 20 minuti 4 volte al giorno per 1 per 2 giorni. Per altri stravasi vescicanti, comprese le antracicline, il trattamento iniziale è orientato alla localizzazione e alla neutralizzazione dell’agente extravasato con impacchi freddi per 20 minuti 4 volte al giorno per 1 o 2 giorni, limitando l’assorbimento cellulare di questi agenti.23
Trattamento farmacologico
DMSO: DMSO è un solvente comune che penetra nei tessuti e migliora la permeabilità della pelle, che può facilitare l’assorbimento di un farmaco extravasato. Quando applicato localmente, ha proprietà di scavenging/anti ossidante dei radicali liberi che possono accelerare la rimozione del farmaco extravasato. DMSO (Rimso-50) è disponibile solo per l’acquisto al dettaglio negli Stati Uniti in una soluzione al 50% (vol/vol) in acqua. Questa soluzione è approvata dalla FDA solo per il trattamento della cistite interstiziale ricorrente.L’efficacia di DMSO per il trattamento dello stravaso chemioterapico è stata descritta per la prima volta in diversi casi clinici e in piccoli studi clinici.
In un caso, uno stravaso di daunorubicina da 10 mg in un uomo di 42 anni è stato trattato con bicarbonato di sodio, desametasone (4 mg), impacchi di ghiaccio e 1,5 ml di DMSO topico 70%, che è stato applicato ogni 3-4 ore per 10 giorni. Questo regime ha fornito sollievo dal dolore e prevenzione dell’ulcera.25
Olver e Schwarz hanno riportato tre casi di risoluzione dello stravaso con l’uso di DMSO.26 In un caso, l’applicazione giornaliera di DMSO 99% per 14 giorni ha portato alla completa risoluzione del dolore entro 2 giorni senza ulcerazione in un paziente con stravaso di doxorubicina. Il paziente ha ricevuto anche bicarbonato di sodio 8,4% e l’appropriato trattamento non farmacologico. (Vedere la TABELLA 2 per le opzioni non farmacologiche.) In un altro caso, un uomo di 49 anni che riceveva da 4 a 6 mg di doxorubicina è stato trattato per lo stravaso di doxorubicina con 5 mL di 8.4% bicarbonato di sodio, impacchi di ghiaccio e DMSO 99% applicato ogni giorno per 14 giorni. Non si è verificata ulcerazione; tuttavia, si è verificata un’area indurita di 3 x 2,5 cm che limita l’estensione del gomito.26 In un terzo caso, un’applicazione topica di DMSO 99% (ogni 6 ore per 1 settimana poi due volte al giorno per un’altra settimana) ha impedito l’ulcerazione; tuttavia, la pigmentazione residua è rimasta.Berghammer et al hanno anche riportato un caso di stravaso di docetaxel.27 Lo stravasato è stato diluito con soluzione salina normale (0,9%) e trattato con impacchi di ghiaccio. DMSO è stato applicato 3 volte ogni 45 minuti e corticosteroidi orali e diclofenac sono stati somministrati il giorno dello stravaso. Tutti i sintomi si sono risolti entro 24 ore; tuttavia, i sintomi ritardati (scolorimento marrone, iperplasia cutanea) sono comparsi il giorno 5 e sono aumentati successivamente. Non era necessario alcun intervento chirurgico plastico. Sebbene DMSO in combinazione con ipotermia e soluzione salina isotonica non fosse efficace nel prevenire i sintomi ritardati, limitava l’infiammazione e la necrosi tissutale.
Ludwig et al hanno riferito che l’uso di una miscela DMSO 90% e alfa-tocoferolo 10% entro 48 ore dopo stravasi di antracicline o mitomicina C in 8 pazienti non ha provocato ulcerazioni cutanee o compromissione funzionale o neurovascolare.28 Sfortunatamente, l’alfa-tocoferolo non è un agente medicinale prontamente disponibile e ulteriori studi randomizzati dovrebbero essere condotti per convalidarne l’uso.
In uno studio prospettico su 20 pazienti con stravaso di antracicline, DMSO 99% è stato somministrato due volte, 6 volte al giorno per 2 settimane.Dopo il trattamento con DMSO non sono state descritte ulcere, sebbene gonfiore iniziale (85%), eritema (75%) e dolore (60%) fossero evidenti. Dopo un periodo di follow-up di 3 mesi in 16 pazienti, 6 (38%) pazienti non avevano sintomi apparenti e 10 (63%) avevano indurimenti pigmentati. Bertelli ha anche condotto uno studio prospettico per valutare gli effetti del DMSO sugli stravasi delle antracicline.30 Doxorubicina rappresentato 11 casi e epirubicina rappresentato 46 casi. I pazienti sono stati trattati con DMSO 99% ogni 8 ore per 7 giorni. Il settanta percento dei pazienti (40/57) aveva una risoluzione completa dello stravaso entro 1 settimana, un paziente aveva un’indurimento residuo dei tessuti molli e un paziente aveva iperpigmentazione residua.
In questi casi e in piccoli studi, gli stravasi sono stati diagnosticati clinicamente e non mediante biopsia. DMSO può essere un’opzione per il trattamento di antracicline extravasate, mitomicina C e actinomicina D. Si raccomanda di applicare un sottile strato di DMSO all’area extravasata e lasciare asciugare. Una medicazione non occlusiva deve essere applicata entro 10-25 minuti. Questi passaggi devono essere ripetuti ogni 8 ore per 7 giorni.23 Sebbene il DMSO sia stato utilizzato nella pratica come opzione per il trattamento, la mancanza di studi prospettici può limitarne l’uso. Le linee guida sullo stravaso EONS 2007 raccomandano di condurre ulteriori studi; tuttavia, DMSO dal 50% al 99% può essere considerato per l’uso a discrezione del clinico.23 È importante notare che nessuno degli studi prospettici DMSO ha utilizzato una benda per consentire alla pelle di assorbire completamente il DMSO.
Ialuronidasi: Si pensa che la ialuronidasi sia in grado di abbattere la matrice extracellulare che è alla base delle cellule epiteliali. La matrice trattiene grandi quantità di molecole d’acqua e, dopo la sua rottura, è in grado di rilasciare il fluido nell’ambiente extracellulare. Nel caso di uno stravaso, consente un aumento del fluido nel sito, diluendo così la concentrazione effettiva della pelle nel sito di contatto.La 31,32 ialuronidasi è stata utilizzata per il trattamento degli stravasi dell’alcaloide della vinca e del taxano.Sono state utilizzate 33 dosi di ialuronidasi da 150 a 1.500 unità diluite in 1 ml di soluzione salina normale per via sottocutanea o intradermica entro 1 ora dallo stravaso.
In un piccolo studio clinico su 6 pazienti con stravaso di vinblastina (n = 1), vincristina (n = 1) e vinorelbina (n = 4), 250 unità di ialuronidasi sono state iniettate nel catetere permanente o per via sottocutanea (6 iniezioni) in caso di lesione. Non sono stati applicati steroidi o impacchi freddi. Il dolore si è risolto entro pochi giorni dal trattamento con ialuronidasi in tutti i pazienti. Un paziente si è lamentato di indurimento leggermente doloroso 3 mesi dopo lo stravaso di vincristina.30 Questi rapporti rivelano informazioni promettenti; tuttavia, vi è ancora una mancanza complessiva di prove per l’uso della ialuronidasi per il trattamento degli stravasi alcaloidi della vinca. Devono essere condotti ulteriori studi prospettici. Le linee guida sullo stravaso EONS 2007 raccomandano di condurre ulteriori studi; tuttavia, la ialuronidasi può essere considerata un’opzione alle dosi suggerite a discrezione del medico.23
Tiosolfato di sodio: Il tiosolfato di sodio previene l’alchilazione e la distruzione dei tessuti fornendo un substrato per l’alchilazione nel tessuto sottocutaneo. Il tiosolfato di sodio è stato dimostrato efficace in esperimenti su animali e in un caso clinico per il trattamento dello stravaso di mechloretamina (senape azotata).33,34 La dose consigliata è di 2 ml di 0,17 M (una soluzione di 4 ml di tiosolfato di sodio al 10% e 6 mL di acqua sterile per preparazioni iniettabili). A causa della mancanza di prove, le linee guida sullo stravaso EONS 2007 non lo raccomandano come antidoto.22
Desrazossano: Dexrazoxane (Totect) è stato recentemente approvato dalla FDA per il trattamento di stravasi indotti da antraciclina. Il dexrazoxano ha un duplice meccanismo d’azione: 1) agisce come chelante del ferro, prevenendo la formazione di complessi ferro-antracicline e radicali idrossilici mediati dal ferro che causano danni ossidativi; e 2) stabilizza la topoisomerasi II e la rende inaccessibile alla chemioterapia antracicline. Il dexrazoxano blocca l’enzima in modo che non sia più influenzato dall’antraciclina e prevenga danni alle cellule sane nei tessuti.l ‘ efficacia del dexrazoxano è stata dimostrata in due studi clinici condotti in Europa.36 Entrambi gli studi erano studi clinici prospettici, in aperto, a braccio singolo, multicentrici condotti da luglio 2001 ad agosto 2005, con un totale di 80 pazienti arruolati. Il primo studio ha arruolato pazienti provenienti da 17 siti oncologici in Danimarca e il secondo ha arruolato pazienti provenienti da 34 siti oncologici in Danimarca, Germania, Italia e Paesi Bassi. Lo stravaso di antraciclina è stato diagnosticato e confermato mediante microscopia a fluorescenza di tessuto biopsiato prelevato entro 6 ore dal dexrazoxano. È stato richiesto un campione di 32 pazienti valutabili per mostrare una riduzione del 70% o superiore dell’incidenza dell’intervento chirurgico (test binomiale unilaterale, a = .025, ß = .20). Il punto finale primario era il tasso di resezione chirurgica e necrosi. Cinquantaquattro degli 80 pazienti (studio 1: n = 18; studio 2: n = 36) erano valutabili (n = 13 biopsie negative; n = 4 nessuna biopsia eseguita; n = 8 violazioni del protocollo), con un’età media di 56 anni (intervallo, 34-81 anni). Il sessantanove percento (n = 37) dei pazienti valutati era di sesso femminile. Dexrazoxano è stato somministrato per infusione endovenosa nell’arco di 12 ore; 1.000 mg / m2 entro 6 ore; 1.000 mg/m2 dopo 24 ore; e 500 mg/m2 dopo 48 ore di stravaso.36
I pazienti sono stati valutati per efficacia e sicurezza ai giorni 7, 14, 21 e 28, e per efficacia al giorno 90,36 La diagnosi di tumore più comune è stata il cancro al seno (50%), seguito da linfoma (39%) e altri tipi di tumore (9%). I pazienti hanno presentato stravasi di doxorubicina (n = 23) o epirubicina (n = 31). L ‘ area media di stravaso è stata di 23,6 cm2 nello studio 1 e di 39 cm2 nello studio 2. Undici pazienti avevano aree di stravaso superiori a 75 cm2. Nello studio 1 e 1 non sono state riscontrate incidenze chirurgiche (2,8%, IC 95% 0,1% -14,5%) nello studio 2. Il paziente che ha sviluppato necrosi tissutale dovuta a stravaso aveva un’area molto ampia di stravaso di doxorubicina di 253 cm2. I sintomi sono aumentati nei giorni successivi allo stravaso, la necrosi tissutale ha iniziato a verificarsi 9 giorni dopo lo stravaso del paziente e la necrosi è stata asportata chirurgicamente. Nello studio 1, c’è stato 1 (5,6%) incidente di necrosi dovuto alla biopsia, 6 (33.3%) episodi di rinvio o annullamento del trattamento programmato per il cancro e 9 (50%) ricoveri dovuti allo stravaso. Nello studio 2, ci sono stati 1 (2,8%) incidenti di necrosi dovuti a stravaso, 3 (8,3%) incidenti di necrosi dovuti a biopsia, 10 (27,8%) incidenti di rinvii o annullamento del trattamento programmato per il cancro a causa dello stravaso e 13 (36,1%) incidenti di ospedalizzazione dovuti allo stravaso. Al follow-up di 3 mesi, l ‘ 88,9% (n = 16) non ha avuto sequele negative nello studio 1 e il 63,9% (n = 23) nello studio 2. Quindici degli 80 pazienti hanno manifestato disturbi sensoriali (n = 9), atrofia cutanea (n = 5), dolore (n = 10), deturpazione (n = 1) e limitazione (n = 3). La maggior parte dei pazienti (71%) è stata in grado di ricevere un ulteriore trattamento chemioterapico nei tempi previsti.
Gli effetti avversi più comuni includevano una diminuzione della conta dei globuli bianchi (72,5%), diminuzione dell’emoglobina (42,5%), diminuzione della conta piastrinica (26%), aumento dell’aspartato aminotransferasi (36,8%), aumento dell’alanina aminotransferasi (23,9%), reazione al sito di iniezione (27,5%) e nausea (18,8%).36 I risultati degli studi clinici hanno rivelato che il dexrazoxano è un agente efficace per il trattamento degli stravasi acuti di antracicline e la prevenzione dei sintomi ritardati.
Un riassunto di queste raccomandazioni terapeutiche, incluse le linee guida EONS 2007, è riportato nella TABELLA 2.
Ruolo del farmacista
I farmacisti devono essere strettamente coinvolti nella valutazione e nella gestione di tutti gli stravasi indotti dalla chemioterapia. Possono svolgere un ruolo integrale in diversi modi, tra cui: 1) sviluppo di politiche e protocolli; 2) educazione paziente, familiare e multidisciplinare; 3) documentazione e segnalazione di stravasi e altre reazioni avverse al farmaco successive alla terapia; e 4) monitoraggio del corretto dosaggio, somministrazione ed efficacia del trattamento.
Conclusione
Tutti gli studi esaminati hanno coinvolto adulti, poiché i pazienti pediatrici avrebbero avuto un aumentato rischio di agitazione e trazione delle linee. Ad oggi, dexrazoxane è l’unico agente extravasation che è stato studiato in grandi, multicentrici, studi prospettici che hanno utilizzato test oggettivi e affidabili per diagnosticare casi di stravaso; questo fornisce una forte evidenza dell’utilità di dexrazoxane. Nonostante i loro usi comuni nella pratica, altri trattamenti farmacologici, come DMSO e ialuronidasi, non sono stati studiati estesamente; pertanto, mancano raccomandazioni basate su prove. La gestione dello stravaso deve essere condotta a discrezione del medico in collaborazione con tutti i membri del team sanitario.
1. Infusion Nurses Society. Standard di pratica infermieristica per infusione. J Infus Nurs. 2006;29 (suppl 1): S1-S92.
2. Polovich M, White J, Kelleher L. Chemioterapia e bioterapia Linee guida e raccomandazioni per la pratica. 2 ° ed. Pittsburgh, PA: Oncology Nursing Society; 2005.
3. Ener RA, Meglathery SB, Styler M. Stravaso di terapie emato-oncologiche sistemiche. Ann Oncol. 2004;15:858-862.
4. Sauerland C, Egelking C, Wickman R, Corbi D. Stravaso vescicante parte I: meccanismi, patogenesi e assistenza infermieristica per ridurre il rischio. Forum Oncol Nurs. 2006;33:1134-1141.
5. Cassagnol M, Cohen H. Dermatologic toxicities of chemotherapeutic agents. US Pharm. 2008;33(1)(Oncology suppl):10-20.
6. Schulmeister L. Extravasation management. Semin Oncol Nurs. 2007;23:184-190.
7. Viale P. Chemotherapy and cutaneous toxicities: implications for oncology nurses. Semin Oncol Nurs. 2006;22:144-151.
8. Cox K, Stuart-Harris R, Abdini G, et al. The management of cytotoxic-drug extravasation: guide-lines drawn up by a working party for the Clinical Oncological Society of Australia. Med J Aust. 1988;148:185-189.
9. Schrijvers DL. Extravasation: una temuta complicazione della chemioterapia. Ann Oncol. 2003; 14 (suppl 3): iii26-iii30.
10. Il Servizio Nazionale di Informazione sullo stravaso. www.extravasation.org.uk/home.html. Accesso 25 marzo 2009.
11. Lemmers N, Gel M, Sleijfer D, et al. Complicanze delle porte di accesso venoso in 132 pazienti con cancro ai testicoli disseminato trattati con polichemioterapia. J Clin Oncol. 1996;14:2916-2922.
12. Shetty PC, Mody MK, Kastan DJ. Risultato di 350 porte toraciche impiantate da radiologi interventisti. J Vasc Interv Radiol. 1997;8:991-995.
13. Dorr RT. Antidoti agli stravasi della chemioterapia vescicante. Sangue Rev. 1990;4:41-60.
14. Langer SW, Sehested M, Jensen PB. Trattamento dello stravaso di antraciclina con dexrazoxano. Clin Cancer Res. 2000;6:3680-3686.
15. Raymond E, Faivre S, Woynarowski JM, Chaney SG. Oxaliplatino: meccanismo d’azione e attività antineoplastica. Semin Oncol. 1998; 2 (suppl 5): 4-12.
16. Rivory LP. Nuovi farmaci per il cancro del colon-retto-meccanismi d’azione. Aust Prescr. 2002;25:108-110. www.australianprescriber.com/magazine/25/5/108/10/. Accesso 25 marzo 2009.
17. Skeel RT. Manuale di chemioterapia del cancro. 5a ed. Nel 1999, fu nominato direttore generale del Dipartimento di Scienze politiche.
18. Boyle DM, Engelking C. Stravaso vescicante: miti e realtà. Forum Oncol Nurs. 1995;22:57-67.
19. Hadaway LC. Prevenzione e gestione dello stravaso periferico. Infermieristico. 2004;34:66-67.
20. Shulmeister L, Camp-Sorrell D. Stravaso di chemioterapia da porte impiantate. Forum Oncol Nurs. 2000;27:531-538.
21. Debets JM, Wils JA, Schlangen JT. Una rara complicazione dei dispositivi di accesso centrale-venoso impiantati: frattura del catetere ed embolizzazione. Supporto Cura Cancro. 1995;3:432-434.
22. Gorski LA. Occlusioni del dispositivo di accesso venoso centrale. Parte 2: Cause e trattamento non trombotici. Casa Healthc Infermiera. 2003;21:168-171.
23. Linee guida stravaso 2007. European Oncology Nursing Society. www.cancerworld.org/CancerWorld/getStaticModFile.aspx?id=2340. Accesso 25 marzo 2009.
24. Foglietto illustrativo Rimso – 50 (dimetilsolfossido). Lago Foresta, IL: Bioniche Pharma USA LLC; 2009.
25. Lawrence HJ, Buonanotte SH. Dimetilsolfossido limitando il danno tissutale causato dallo stravaso di agenti doxorubicina. Ann Stagista Med. 1983;98:1025.
26. Olver IN, Schwarz MA. Use of dimethyl sulfoxide in limiting tissue damage caused by extravasation of doxorubicin . Cancer Treat Rep. 1983;67:407-408.
27. Berghammer P, Pohnl R, Baur M, Dittrich C. Docetaxel extravasation. Support Care Cancer. 2001;9:131-134.
28. Ludwig CU, Stoll HR, Obrist R, Obrecht JP. Prevention of cytotoxic drug-induced skin ulcers with dimethyl sulfoxide (DMSO) and alpha-tocopherole. Eur J Cancer Clin Oncol. 1987;23:327-329.
29. Olver IN, Aisner J, Hament A, et al. A prospective study of topical dimethyl sulfoxide for treating anthracycline extravasation. J Clin Oncol.1988;6:1732-1735.
30. Bertelli G. Prevention and management of extravasation of cytotoxic drugs. Drug Saf. 1995;12:245-255.
31. Balazs EA, Laurent TC, Jeanloz RW. Nomenclature of hyaluronic acid. Biochem J. 1986;235:903.
32. Girish KS, Kemparaju K. The magic glue hyaluronan and its eraser hyaluronidase. Life Sci. 2007;80:1921-1943.
33. Dorr T. Antidotes to vesicant chemotherapy extravasations. Blood Rev. 1990;4:41-60.
34. Owen OE, Dellatorre DL, Van Scott EJ, Cohen MR. Accidental intramuscular injection of mechlorethamine. Cancer. 1980;45:2225-2226.
35. Totect (dexrazoxane for injection) package insert. Copenhagen, Denmark: TopoTarget A/S; October 2007.
36. Mouridsen HT, Langer SW, Buter J, et al. Treatment of anthracycline extravasation with Savene (dexrazoxane). Results from two prospective clinical multicenter studies. Ann Oncol. 2007;18:546-550.
Leave a Reply