Chimica: cosa sono acidi e basi?
Che cosa sono acidi e basi?
Anche se ti ho detto che gli acidi e le basi non sono difficili da capire, ho una cattiva notizia: non ci sono una ma tre definizioni comuni utilizzate per descrivere acidi e basi: acidi e basi di Arrhenius, acidi e basi di Brnsted-Lowry e acidi e basi di Lewis. Anche se questo fa sembrare come se si dovrà conoscere acidi e basi tre volte, la buona notizia è che per molti scopi pratici, queste tre definizioni sono approssimativamente equivalenti.
Acidi e basi Arrhenius
Nel lontano 1800, il nostro vecchio amico Svante Arrhenius si avvicinò con definizioni di acidi e basi mentre si lavora su problemi cinetici.
Secondo Arrhenius, gli acidi sono composti che si rompono in acqua per emettere ioni idronio (H+). Un esempio comune di acido Arrhenius è l’acido cloridrico (HCl):
- HCl ? H + + Cl –
Le formule per gli acidi di solito iniziano con l’idrogeno, anche se gli acidi organici sono una notevole eccezione. I nomi e le formule di alcuni comuni acidi sono riportate nella tabella seguente:
| Acido Nome | Formula |
|---|---|
| acido cloridrico | HCl |
| acido nitrico | HNO3 |
| acido fosforico | H3PO4 |
| acido solforico | H2SO4 |
| acido acetico | C2H4O2 |
basi di Arrhenius sono definiti come composti che causano la formazione di idrossido di ioni, quando sono immessi in acqua. Un esempio di base di Arrhenius è l’idrossido di sodio (NaOH):
- NaOH ? Na + + OH –
Le basi hanno tipicamente “OH” nelle loro formule, anche se ci sono delle eccezioni. Ad esempio, l’ammoniaca (NH3) non contiene ioni idrossido ma li forma quando reagisce con l’acqua:
- NH3 + H2O ? NH4 + + OH –
I nomi e le formule di alcune basi comuni sono nella seguente tabella:
| Nome | Formula |
|---|---|
| ammoniaca | NH3 |
| idrossido di potassio | KOH |
| bicarbonato di sodio | NaHCO3 |
| carbonato di sodio | Na2CO3 |
| idrossido di sodio | NaOH |
Alcuni ossidi forma di acidi o basi quando viene aggiunta acqua. Poiché questi composti non contengono ioni H + o OH a meno che non reagiscano con l’acqua, sono chiamati “anidridi.”Tipicamente, gli ossidi di non metalli sono anidridi acide (formano acido quando vengono posti in acqua) e gli ossidi di metalli sono anidridi di base (formando una base quando vengono posti in acqua).
Acidi e basi di Brnsted-Lowry
Nei primi anni del 1900, una definizione alternativa per acidi e basi è stata proposta da Johannes Brnsted e Thomas Lowry per tenere conto del fatto che l’ammoniaca può neutralizzare l’acidità di HCl anche se l’acqua non è presente. Questo fenomeno ha mostrato loro che l’ammoniaca è una base, anche quando non c’è acqua intorno per formare ioni idrossido.
Ci sono molti nomi e formule diversi usati per descrivere lo hyd idronio. Sebbene la formula sia stata mostrata in precedenza come ” H+”, a volte è scritta come” H3O ” perché questo è lo ion formato quando H+ si combina con l’acqua. Un altro modo comune di riferirsi agli ioni idronio è solo chiamarli ” protoni.”Questo nome deriva dal fatto che H+ rappresenta un atomo di idrogeno (un protone e un elettrone) che ha perso il suo elettrone, lasciando solo il protone nudo dietro.
Un acido di Brnsted-Lowry è definito come un composto che dà ioni idronio ad un altro composto?ad esempio, l’acido cloridrico dà ioni H + ai composti con cui reagisce. Le basi di Brnsted-Lowry sono composti che possono accettare ioni idronio?quando l’ammoniaca ottiene uno ion idronio da HCl, forma lo ammonium ammonio.
La seguente equazione rappresenta la reazione di un acido di Brnsted-Lowry con una base di Brnsted-Lowry:
- HNO3 + NH3 ? NO3 – + NH4 +
In questa reazione, l’acido nitrico si comporta come un acido perché dà un protone all’ammoniaca. L’ammoniaca si comporta come una base perché accetta il protone dall’acido nitrico.
Tuttavia, se si dà un’occhiata all’altro lato dell’equazione, troviamo gli ioni nitrato e ammonio. Poiché lo nitrate nitrato può accettare protoni dallo ammonium ammonio (per formare HNO3), lo ion nitrato è una base molto debole di Brnsted-Lowry. Poiché lo ammonium ammonio ha un protone extra da donare (in questo caso allo ion nitrato), è un acido di Brnsted-Lowry.
Lo nitrate nitrato si basa sulla molecola di acido nitrico, quindi diciamo che è la base coniugata dell’acido nitrico. Allo stesso modo, lo ammonium ammonio è l’acido coniugato dell’ammoniaca. Insieme, un acido con la sua base coniugata (come HNO3 e NO3-) o una base con il suo acido coniugato (come NH3 e NH4+) viene indicato come una coppia acido-base coniugata.
Acidi e basi di Lewis
Nella definizione di Brnsted-Lowry di acidi e basi, una base è definita come un composto che può accettare un protone. Tuttavia, come accetta il protone?
Una caratteristica che le basi di Brnsted-Lowry hanno in comune tra loro è che hanno una coppia di elettroni non condivisa. Quando uno ion idronio viene vagando dalla molecola, a volte le coppie solitarie raggiungeranno e afferrarlo. Un esempio di questo è quando l’ammoniaca accetta un protone in una soluzione acida:
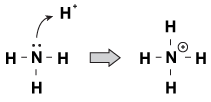
Figura 23.1 L’ammoniaca può afferrare un protone dall’acido nitrico con la sua sola coppia di elettroni.
Un modo di guardare a questo processo è che l’atomo di ammoniaca sta donando la sua coppia solitaria al protone. Poiché le coppie solitarie stanno guidando questa reazione chimica, abbiamo una nuova definizione di acidità e basicità, chiamata “Acidità di Lewis/basicità.”Una base di Lewis è un composto che dona una coppia di elettroni ad un altro composto (l’ammoniaca nel nostro esempio). Un acido di Lewis è un composto che accetta una coppia di elettroni (lo ion H+ nel nostro esempio).
Le basi di Lewis sono sostanze chimiche che possono donare coppie di elettroni. Gli acidi di Lewis sono sostanze chimiche che possono accettarli.
Anche se abbiamo avuto ammoniaca donare una coppia solitaria ad un protone nel nostro esempio, la coppia solitaria in ammoniaca può reagire con un sacco di altri composti pure. Ad esempio, l’ammoniaca può donare la sua coppia solitaria di elettroni a BH3 con il seguente processo:

Figura 23.2 La coppia solitaria sull’ammoniaca che si attacca a BH3.
In questo processo, l’ammoniaca è la base di Lewis e BH3 è l’acido di Lewis.
Generalmente, la definizione di Lewis di acidi e basi è la più utile perché è la più inclusiva delle tre definizioni. Ad esempio, la definizione di Brnsted-Lowry di un acido include HF ma non BH3, che non perde un protone quando viene attaccato dalle coppie solitarie su una base di Lewis.
Tratto da The Complete Idiot’s Guide to Chemistry 2003 di Ian Guch. Tutti i diritti riservati compreso il diritto di riproduzione in tutto o in parte in qualsiasi forma. Utilizzato in accordo con Alpha Books, membro di Penguin Group (USA) Inc.
Per ordinare questo libro direttamente dall’editore, visitare il sito web Penguin USA o chiamare il numero 1-800-253-6476. È inoltre possibile acquistare questo libro a Amazon.com e Barnes & Noble.
Leave a Reply