Carbon: the essentials
Il carbonio è un elemento del Gruppo 14 ed è distribuito molto ampiamente in natura. Si trova in abbondanza nel sole, nelle stelle, nelle comete e nelle atmosfere della maggior parte dei pianeti. Il carbonio è presente come anidride carbonica nell’atmosfera e disciolto in tutte le acque naturali. È un componente delle rocce come carbonati di calcio (calcare), magnesio e ferro. L’atmosfera di Marte è molto sottile ma ciò che c’è contiene circa il 95% di CO2.
Carbone, petrolio e gas naturale sono principalmente idrocarburi. Il carbonio è unico tra gli elementi nel vasto numero di varietà di composti che può formare. La chimica organica, un sottoinsieme 1 / 112th della chimica inorganica, è lo studio del carbonio e dei suoi composti. Mentre il silicio potrebbe prendere il posto del carbonio nella formazione di una serie di composti correlati, attualmente non è possibile formare composti stabili con catene molto lunghe di atomi di silicio.
Il carbonio si trova libero in natura in tre forme allotropiche: amorfo, grafite e diamante. La grafite è uno dei materiali più morbidi conosciuti mentre il diamante è uno dei più duri. Il carbonio, come diamanti microscopici, si trova in alcuni meteoriti. I diamanti naturali si trovano in antichi “tubi” vulcanici come quelli trovati in Sud Africa. I diamanti sono anche recuperati dal fondo dell’oceano al largo del Capo di Buona Speranza.

Un anello di diamanti.
Più recentemente, è stata scoperta un’altra forma di carbonio, buckminsterfullerene, C60. Questa forma di carbonio è oggi oggetto di grande interesse nei laboratori di ricerca.
Il carbonio puro è disponibile in diverse forme (allotropi). La forma più comune di carbonio puro è α-grafite. Questa è anche la forma termodinamicamente più stabile. Il diamante è una seconda forma di carbonio ma è molto meno comune. Altre forme di carbonio includono i fullereni. Mentre il diamante e la grafite sono reticoli infiniti, fullereni come buckminsterfullerene, C60, è una specie molecolare discreta. Le forme amorfe di carbonio come fuliggine e nerofumo sono materiali costituiti da particelle molto piccole di grafite.
La maggior parte della grafite è α-grafite e possiede una struttura a strati in cui ogni carbonio è direttamente legato ad altri tre atomi di carbonio ad una distanza di 141,5 pm. La delocalizzazione nel legame è evidente poiché le distanze C-C sono uguali e più brevi dei normali legami carbonio-carbonio (tipicamente 154 pm). La distanza tra gli strati di atomi di carbonio è 335,4 pm. Nella maggior parte della grafite (α-grafite), gli strati di atomi sono disposti in un ABABAB… ripeti la moda ma la forma β (romboedrica) l’impilamento è ABCABCABC… sebbene le distanze carbonio-carbonio e la spaziatura intercalare rimangano le stesse della forma α. La differenza di entalpia tra α-e α-grafite è inferiore a 1 kJ mol-1 (0,59 ± 0,17 kJ mol-1. Le forme degli elementi più pesanti corrispondenti alla grafite non sono note e le strutture di silicio, germanio e stagno grigio sono correlate alla struttura del diamante (sotto).

Disposizioni atomiche nelle allotrops più comuni di carbonio: α-grafite.
Poiché il diamante ha una struttura leggermente più compatta, la sua densità è maggiore di quella della grafite. L’aspetto del diamante è ben noto ed è anche uno dei materiali più duri conosciuti. Come la grafite, è relativamente non reattivo, ma brucia in aria a 600-800°C. Ogni atomo di carbonio è legato a quattro vicini ad una distanza di 154.45 pm in modo tetraedrico e quindi ogni cristallo di diamante è una singola struttura reticolare gigante. In linea di principio (e in pratica!) la grafite può essere convertita in diamante mediante l’applicazione di calore e pressione. La cella unitaria del diamante è cubica con a = 356.68 pm. Quasi tutti i diamanti possiedono questa struttura, ma una percentuale molto piccola mostra una struttura esagonale legata alla wurtzite e questi sono chiamati lonsdaleite.

Strucutres di cristallo di diamante.
Recentemente è stato caratterizzato un altro allotropo del carbonio. Mentre diamante e grafite sono reticoli infinite, buckminsterfullerene, C60, è una specie molecolare discreta. La molecola buckminsterfullerene è una rete di 12 pentagoni e 20 esagoni piegati in una sfera. L’effetto è molto simile al patchwork di 12 pezzi pentagonali e 20 esagonali di pelle che cuciti insieme compongono un calcio di associazione (pallone da calcio). Il nome buckminsterfullerene (o buckyball è stato coniato a causa della relazione tra la struttura di C60 e R. disegni cupola geodetica di Buckminster Fuller. Buckminsterfullerene è ora disponibile in commercio ed è stato anche identificato nello spazio interstellare e fuliggine.
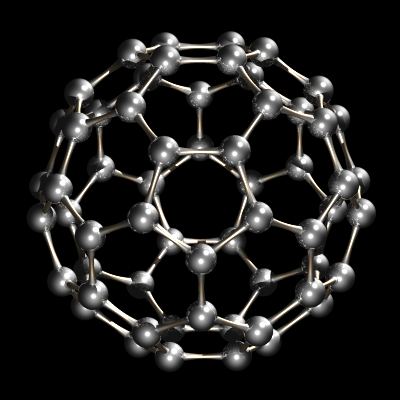
C60, Buckminsterfullerene.
Altri fullereni (gabbie di carbonio chiuse) come C60 e C84 sono noti e disponibili commercialmente. Il fullerene più piccolo possibile è il dodecaedrico C20, costituito da 12 pentagoni e nessun esagono. I nanotubi sono legati ai fullereni. Sono tubi che danno l’aspetto di grafite laminata, sebbene siano fatti di grafite. Sono aperti mentre i fullereni sono strutture chiuse.
Una caratteristica interessante dei fullereni è la loro capacità di racchiudere atomi come il potassio e altri metalli alcalini per creare strutture endoedriche indicate come K@C60.
Nel 1961 l’Unione Internazionale di Chimica Pura e Applicata (IUPAC) adottò l’isotopo 12C come base per i pesi atomici. Il carbonio-14, 14C, un isotopo con un’emivita di 5730 anni, viene utilizzato per datare materiali come legno, campioni archeologici, ecc. Il carbonio-13, 13C, è particolarmente utile per gli studi di etichettatura isotopica poiché non è radioattivo, ma è un nucleo spin I = 1/2 e quindi un buon nucleo NMR.
Leave a Reply