Biologia per Majors I
Risultati di apprendimento
- Identificare i componenti di semplici reazioni chimiche
Tutti gli elementi sono più stabili quando il loro guscio più esterno è riempito di elettroni secondo la regola dell’ottetto. Questo perché è energeticamente favorevole per gli atomi di essere in quella configurazione e li rende stabili. Tuttavia, poiché non tutti gli elementi hanno abbastanza elettroni per riempire i loro gusci più esterni, gli atomi formano legami chimici con altri atomi ottenendo così gli elettroni di cui hanno bisogno per raggiungere una configurazione elettronica stabile. Quando due o più atomi si legano chimicamente l’uno con l’altro, la struttura chimica risultante è una molecola. La molecola d’acqua familiare, H2O, consiste di due atomi di idrogeno e un atomo di ossigeno; questi si legano insieme per formare acqua, come illustrato nella Figura 1. Gli atomi possono formare molecole donando, accettando o condividendo elettroni per riempire i loro gusci esterni.
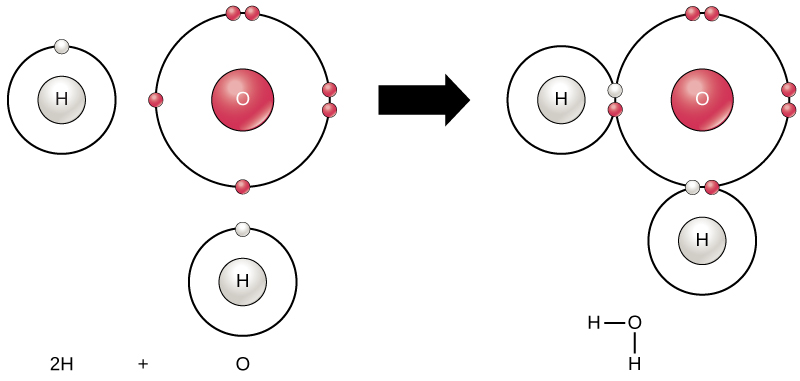
Figura 1. Due o più atomi possono legarsi tra loro per formare una molecola. Quando due idrogeni e un ossigeno condividono elettroni tramite legami covalenti, si forma una molecola d’acqua.
Le reazioni chimiche si verificano quando due o più atomi si legano insieme per formare molecole o quando gli atomi legati vengono spezzati. Le sostanze utilizzate all’inizio di una reazione chimica sono chiamate reagenti (di solito si trovano sul lato sinistro di un’equazione chimica) e le sostanze trovate alla fine della reazione sono note come prodotti (di solito si trovano sul lato destro di un’equazione chimica). Una freccia è tipicamente disegnato tra i reagenti e prodotti per indicare la direzione della reazione chimica; questa direzione non è sempre una “strada a senso unico.”Per la creazione della molecola d’acqua mostrata sopra, l’equazione chimica sarebbe:
2H + O → H2O
Un esempio di una semplice reazione chimica è la scomposizione di molecole di perossido di idrogeno, ognuna delle quali consiste di due atomi di idrogeno legati a due atomi di ossigeno (H2O2). Il perossido di idrogeno reagente è suddiviso in acqua, contenente un atomo di ossigeno legato a due atomi di idrogeno (H2O) e ossigeno, che consiste di due atomi di ossigeno legati (O2). Nell’equazione seguente, la reazione include due molecole di perossido di idrogeno e due molecole d’acqua. Questo è un esempio di un’equazione chimica bilanciata, in cui il numero di atomi di ciascun elemento è lo stesso su ciascun lato dell’equazione. Secondo la legge di conservazione della materia, il numero di atomi prima e dopo una reazione chimica dovrebbe essere uguale, in modo tale che nessun atomo venga, in circostanze normali, creato o distrutto.
2H2O2 (perossido di idrogeno) → 2 H2O(acqua) + O2 (ossigeno)
Anche se tutti i reagenti e i prodotti di questa reazione sono molecole (ogni atomo rimane legato ad almeno un altro atomo), in questa reazione solo il perossido di idrogeno e acqua sono rappresentativi di una sottoclasse di molecole conosciute come composti: contengono atomi di più di un tipo di elemento. L’ossigeno molecolare, d’altra parte, come mostrato nella Figura 2, è costituito da due atomi di ossigeno doppiamente legati e non è classificato come composto ma come elemento.
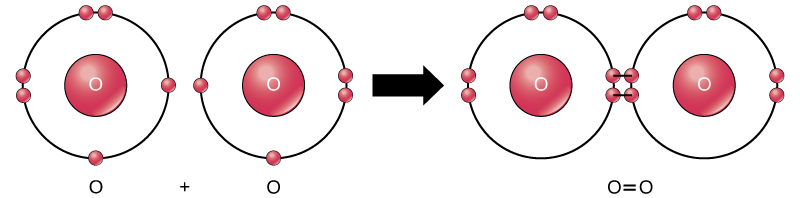
Figura 2. Gli atomi di ossigeno in una molecola di O2 sono uniti da un doppio legame.
Alcune reazioni chimiche, come quella mostrata sopra, possono procedere in una direzione fino a quando i reagenti non sono tutti esauriti. Le equazioni che descrivono queste reazioni contengono una freccia unidirezionale e sono irreversibili. Le reazioni reversibili sono quelle che possono andare in entrambe le direzioni. Nelle reazioni reversibili, i reagenti vengono trasformati in prodotti, ma quando la concentrazione del prodotto supera una certa soglia (caratteristica della particolare reazione), alcuni di questi prodotti saranno riconvertiti in reagenti; a questo punto, le denominazioni di prodotti e reagenti sono invertite. Questo avanti e indietro continua fino a quando si verifica un certo equilibrio relativo tra reagenti e prodotti—uno stato chiamato equilibrio. Queste situazioni di reazioni reversibili sono spesso indicate da un’equazione chimica con una freccia a doppia testa che punta verso sia i reagenti che i prodotti.
Ad esempio, nel sangue umano, gli ioni idrogeno in eccesso (H+) si legano agli ioni bicarbonato (HCO3–) formando uno stato di equilibrio con l’acido carbonico (H2CO3). Se l’acido carbonico fosse aggiunto a questo sistema, alcuni di essi sarebbero convertiti in ioni bicarbonato e idrogeno.
HCO3 – + H + ↔ H2CO3
Nelle reazioni biologiche, tuttavia, l’equilibrio è raramente ottenuto perché le concentrazioni dei reagenti o dei prodotti o di entrambi cambiano costantemente, spesso con un prodotto di una reazione che è un reagente per un altro. Per tornare all’esempio di ioni idrogeno in eccesso nel sangue, la formazione di acido carbonico sarà la direzione principale della reazione. Tuttavia, l’acido carbonico può anche lasciare il corpo come gas di anidride carbonica (via espirazione) invece di essere riconvertito in bic bicarbonato, guidando così la reazione a destra dalla legge chimica nota come legge dell’azione di massa. Queste reazioni sono importanti per mantenere l’omeostasi del nostro sangue.
HCO3– + H+ ↔ H2CO3 ↔ CO2 + H2O
In sintesi: Reazioni chimiche e molecole
Il guscio esterno dell’elettrone determina quanto facilmente e quale tipo di legami chimici si formerà un particolare atomo. La formazione di composti è spesso delineata visivamente in equazioni chimiche che mostrano i reagenti che partecipano alle reazioni chimiche per formare prodotti.
Provalo
Contribuisci!
Migliora questa paginaimpara di più
Leave a Reply