6.4: ATP: l’Adenosina Trifosfato
sviluppo
- Spiegare il ruolo dell’ATP come l’energia cellulare, valuta
- Descrivere come l’energia viene rilasciata attraverso l’idrolisi di ATP
Anche exergonic, energia a rilascio di reazioni richiedono una piccola quantità di energia di attivazione per poter procedere. Tuttavia, considera le reazioni endergoniche, che richiedono molto più energia, perché i loro prodotti hanno più energia libera dei loro reagenti. All’interno della cellula, da dove viene l’energia per alimentare tali reazioni? La risposta sta in una molecola che fornisce energia chiamata adenosina trifosfato, o ATP. L’ATP è una molecola piccola e relativamente semplice (Figura \ (\PageIndex{1}\)), ma all’interno di alcuni dei suoi legami, contiene il potenziale per una rapida esplosione di energia che può essere sfruttata per eseguire il lavoro cellulare. Questa molecola può essere pensata come la valuta energetica primaria delle cellule nello stesso modo in cui il denaro è la valuta che le persone scambiano per le cose di cui hanno bisogno. L’ATP è usato per alimentare la maggior parte delle reazioni cellulari che richiedono energia.

Come suggerisce il nome, l’adenosina trifosfato è costituito da adenosina legata a tre gruppi fosfato (Figura \(\PageIndex{1}\)). L’adenosina è un nucleoside costituito dall’adenina base azotata e da uno zucchero a cinque atomi di carbonio, ribosio. I tre gruppi fosfato, in ordine di più vicino al più lontano dallo zucchero ribosio, sono etichettati alfa, beta e gamma. Insieme, questi gruppi chimici costituiscono una centrale elettrica energetica. Tuttavia, non tutti i legami all’interno di questa molecola esistono in uno stato particolarmente ad alta energia. Entrambi i legami che collegano i fosfati sono legami ugualmente ad alta energia (legami fosfoanidrici) che, una volta rotti, rilasciano energia sufficiente per alimentare una varietà di reazioni e processi cellulari. Questi legami ad alta energia sono i legami tra il secondo e il terzo gruppo fosfato (o beta e gamma) e tra il primo e il secondo gruppo fosfato. La ragione per cui questi legami sono considerati “ad alta energia” è perché i prodotti di tale rottura del legame-adenosina difosfato (ADP) e un gruppo fosfato inorganico (Pi)—hanno un’energia libera notevolmente inferiore rispetto ai reagenti: ATP e una molecola d’acqua. Poiché questa reazione avviene con l’uso di una molecola d’acqua, è considerata una reazione di idrolisi. In altre parole, l’ATP viene idrolizzato in ADP nella seguente reazione:
Come la maggior parte delle reazioni chimiche, l’idrolisi dell’ATP in ADP è reversibile. La reazione inversa rigenera ATP da ADP + Pi. In effetti, le cellule si basano sulla rigenerazione dell’ATP proprio come le persone si affidano alla rigenerazione del denaro speso attraverso una sorta di reddito. Poiché l’idrolisi dell’ATP rilascia energia, la rigenerazione dell’ATP deve richiedere un apporto di energia libera. La formazione di ATP è espressa in questa equazione:
Rimangono due questioni importanti per quanto riguarda l’uso di ATP come fonte di energia. Esattamente quanta energia libera viene rilasciata con l’idrolisi dell’ATP e come viene utilizzata quell’energia libera per svolgere il lavoro cellulare? Il calculated G calcolato per l’idrolisi di una mole di ATP in ADP e Pi è -7,3 kcal / mole (-30,5 kJ/mol). Poiché questo calcolo è vero in condizioni standard, ci si aspetterebbe che un valore diverso esista in condizioni cellulari. Infatti, il ∆G per l’idrolisi di una mole di ATP in una cellula vivente è quasi il doppio del valore in condizioni standard: 14 kcal/mol (-57 kJ/mol).
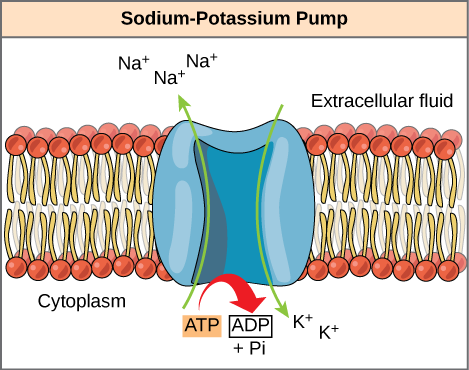
L’ATP è una molecola altamente instabile. A meno che non venga rapidamente utilizzato per eseguire il lavoro, l’ATP si dissocia spontaneamente in ADP + Pi e l’energia libera rilasciata durante questo processo viene persa sotto forma di calore. La seconda domanda posta sopra, cioè come l’energia rilasciata dall’idrolisi dell’ATP viene utilizzata per eseguire il lavoro all’interno della cellula, dipende da una strategia chiamata accoppiamento energetico. Le cellule accoppiano la reazione exergonica dell’idrolisi dell’ATP con le reazioni endergoniche, permettendo loro di procedere. Un esempio di accoppiamento energetico utilizzando ATP comporta una pompa ionica transmembrana che è estremamente importante per la funzione cellulare. Questa pompa sodio-potassio (pompa Na+/K+) spinge il sodio fuori dalla cellula e il potassio nella cellula (Figura 6.4.2). Una grande percentuale di ATP di una cellula viene spesa per alimentare questa pompa, perché i processi cellulari portano una grande quantità di sodio nella cellula e di potassio fuori dalla cellula. La pompa lavora costantemente per stabilizzare le concentrazioni cellulari di sodio e potassio. Affinché la pompa giri un ciclo (esportando tre ioni Na+ e importando due ioni K+), una molecola di ATP deve essere idrolizzata. Quando l’ATP viene idrolizzato, il suo fosfato gamma non galleggia semplicemente, ma viene effettivamente trasferito sulla proteina della pompa. Questo processo di un gruppo fosfato che si lega a una molecola è chiamato fosforilazione. Come con la maggior parte dei casi di idrolisi di ATP, un fosfato da ATP viene trasferito su un’altra molecola. In uno stato fosforilato, la pompa Na + / K + ha più energia libera e viene attivata per subire un cambiamento conformazionale. Questa modifica consente di rilasciare Na + all’esterno della cella. Poi lega il K + extracellulare, che, con un altro cambiamento conformazionale, induce il fosfato a staccarsi dalla pompa. Questo rilascio di fosfato innesca il K + per essere rilasciato all’interno della cellula. Essenzialmente, l’energia rilasciata dall’idrolisi dell’ATP è accoppiata con l’energia necessaria per alimentare la pompa e trasportare ioni Na+ e K+. ATP esegue il lavoro cellulare utilizzando questa forma di base di accoppiamento di energia attraverso la fosforilazione.
L’idrolisi di una molecola di ATP rilascia 7,3 kcal/mol di energia (G G = -7,3 kcal/mol di energia). Se occorrono 2,1 kcal / mol di energia per spostare un Na + attraverso la membrana (G G = + 2,1 kcal / mol di energia), quanti ioni di sodio potrebbero essere spostati dall’idrolisi di una molecola di ATP?
Spesso durante le reazioni metaboliche cellulari, come la sintesi e la disgregazione dei nutrienti, alcune molecole devono essere leggermente alterate nella loro conformazione per diventare substrati per il passo successivo nella serie di reazioni. Un esempio è durante i primi passi della respirazione cellulare, quando una molecola del glucosio dello zucchero viene scomposta nel processo di glicolisi. Nella prima fase di questo processo, l’ATP è richiesto per la fosforilazione del glucosio, creando un intermedio ad alta energia ma instabile. Questa reazione di fosforilazione alimenta un cambiamento conformazionale che consente alla molecola di glucosio fosforilato di essere convertita nel fruttosio di zucchero fosforilato. Il fruttosio è un intermedio necessario per la glicolisi per andare avanti. Qui, la reazione exergonica dell’idrolisi dell’ATP è accoppiata con la reazione endergonica di convertire il glucosio in un intermedio fosforilato nella via. Ancora una volta, l’energia rilasciata rompendo un legame fosfato all’interno dell’ATP è stata utilizzata per la fosforilazione di un’altra molecola, creando un intermedio instabile e alimentando un importante cambiamento conformazionale.

Vedere un’animazione interattiva del processo di glicolisi che produce ATP in questo sito.
Sommario
L’ATP è la molecola primaria che fornisce energia alle cellule viventi. L’ATP è costituito da un nucleotide, uno zucchero a cinque atomi di carbonio e tre gruppi fosfatici. I legami che collegano i fosfati (legami fosfoanidrici) hanno un alto contenuto energetico. L’energia rilasciata dall’idrolisi di ATP in ADP + Pi viene utilizzata per eseguire il lavoro cellulare. Le cellule usano l’ATP per eseguire il lavoro accoppiando la reazione exergonica dell’idrolisi di ATP con reazioni endergoniche. ATP dona il suo gruppo fosfato ad un’altra molecola attraverso un processo noto come fosforilazione. La molecola fosforilata è in uno stato di energia superiore ed è meno stabile della sua forma non fosforilata, e questa energia aggiunta dall’aggiunta del fosfato consente alla molecola di subire la sua reazione endergonica.
Connessioni Art
L’idrolisi di una molecola di ATP rilascia 7,3 kcal / mol di energia (G G = -7,3 kcal / mol di energia). Se ci vuole 2.1 kcal / mol di energia per spostare un Na + attraverso la membrana (∆G = + 2,1 kcal / mol di energia), quanti ioni di sodio potrebbero essere spostati dall’idrolisi di una molecola di ATP?
Tre ioni di sodio potrebbero essere spostati dall’idrolisi di una molecola di ATP. Il ∆G della reazione accoppiata deve essere negativo. Il movimento di tre ioni di sodio attraverso la membrana richiederà 6,3 kcal di energia (2,1 kcal × 3 Na+ ioni = 6,3 kcal). L’idrolisi dell’ATP fornisce 7,3 kcal di energia, più che sufficiente per alimentare questa reazione. Il movimento di quattro ioni di sodio attraverso la membrana, tuttavia, richiederebbe 8.4 kcal di energia, più di una molecola di ATP può fornire.
le Domande di Revisione
L’energia liberata dall’idrolisi di ATP è
- principalmente conservati tra alfa e beta fosfati
- pari a -57 kcal/mol
- sfruttata come calore energia per la cellula di eseguire i lavori
- fornire energia a reazioni accoppiate
D
Quale delle seguenti molecole è probabile che la maggior parte di energia potenziale?
- saccarosio
- ATP
- glucosio
- ADP
Risposta
Pensi che la EA per idrolisi dell’ATP è relativamente bassa o alta? Spiega il tuo ragionamento.
L’energia di attivazione per l’idrolisi è molto bassa. Non solo l’idrolisi dell’ATP è un processo exergonico con un grande G G, ma l’ATP è anche una molecola molto instabile che si scompone rapidamente in ADP + Pi se non viene utilizzata rapidamente. Questo suggerisce un EA molto basso poiché idrolizza così rapidamente.
Glossario
ATP adenosina trifosfato, la cella di energia valuta phosphoanhydride legame legame che collega i fosfati in una molecola
Collaboratori e Attribuzioni
-
Connie Segale (a Est del Mississippi Community College), di Robert Wise (Università del Wisconsin Oshkosh), Vladimir Jurukovski (Suffolk County Community College), Jean DeSaix (Università di North Carolina a Chapel Hill), Jung Choi (Georgia Institute of Technology), Yael Avissar (Rhode Island College) tra gli altri autori. Contenuto originale di OpenStax (CC BY 4.0; Scarica gratuitamente da http://cnx.org/contents/185cbf87-c72…[email protected]).
Leave a Reply