13.7: Composti Aromatici – Benzene
Obiettivi formativi
- Descrivere il legame nel benzene e il modo in cui le reazioni tipiche del benzene differiscono da quelle degli alcheni.
Successivamente consideriamo una classe di idrocarburi con formule molecolari come quelle degli idrocarburi insaturi, ma che, a differenza degli alcheni, non subiscono prontamente reazioni di addizione. Questi composti comprendono una classe distinta, chiamata idrocarburi aromatici, con strutture e proprietà uniche. Iniziamo con il più semplice di questi composti. Il benzene (C6H6) è di grande importanza commerciale, ma ha anche notevoli effetti sulla salute.
La formula C6H6 sembra indicare che il benzene ha un alto grado di insaturazione. (Esano, l’idrocarburo saturo con sei atomi di carbonio ha la formula C6H14-otto atomi di idrogeno in più rispetto al benzene.) Tuttavia, nonostante l’apparente basso livello di saturazione, il benzene è piuttosto irreattivo. Ad esempio, non reagisce prontamente con il bromo, che è un test per l’insaturazione.
Il benzene è un liquido che odora di benzina, bolle a 80°C e si congela a 5,5°C. È l’idrocarburo aromatico prodotto nel volume più grande. Precedentemente era usato per decaffeinare il caffè ed era una componente significativa di molti prodotti di consumo, come svernicianti, cementi di gomma e detergenti per la pulizia a secco. È stato rimosso da molte formulazioni del prodotto negli anni ’50, ma altri hanno continuato a utilizzare il benzene nei prodotti fino agli anni’ 70 quando è stato associato a decessi per leucemia. Il benzene è ancora importante nell’industria come precursore nella produzione di materie plastiche (come polistirolo e nylon), farmaci, detergenti, gomma sintetica, pesticidi e coloranti. È usato come solvente per cose come la pulizia e la manutenzione delle apparecchiature di stampa e per adesivi come quelli usati per attaccare le suole alle scarpe. Il benzene è un costituente naturale dei prodotti petroliferi, ma poiché è un noto cancerogeno, il suo uso come additivo nella benzina è ora limitato.
Per spiegare le sorprendenti proprietà del benzene, i chimici suppongono che la molecola abbia una struttura ciclica, esagonale, planare di sei atomi di carbonio con un atomo di idrogeno legato a ciascuno. Possiamo scrivere una struttura con legami singoli e doppi alternati, sia come formula strutturale completa che come formula angolo di linea:
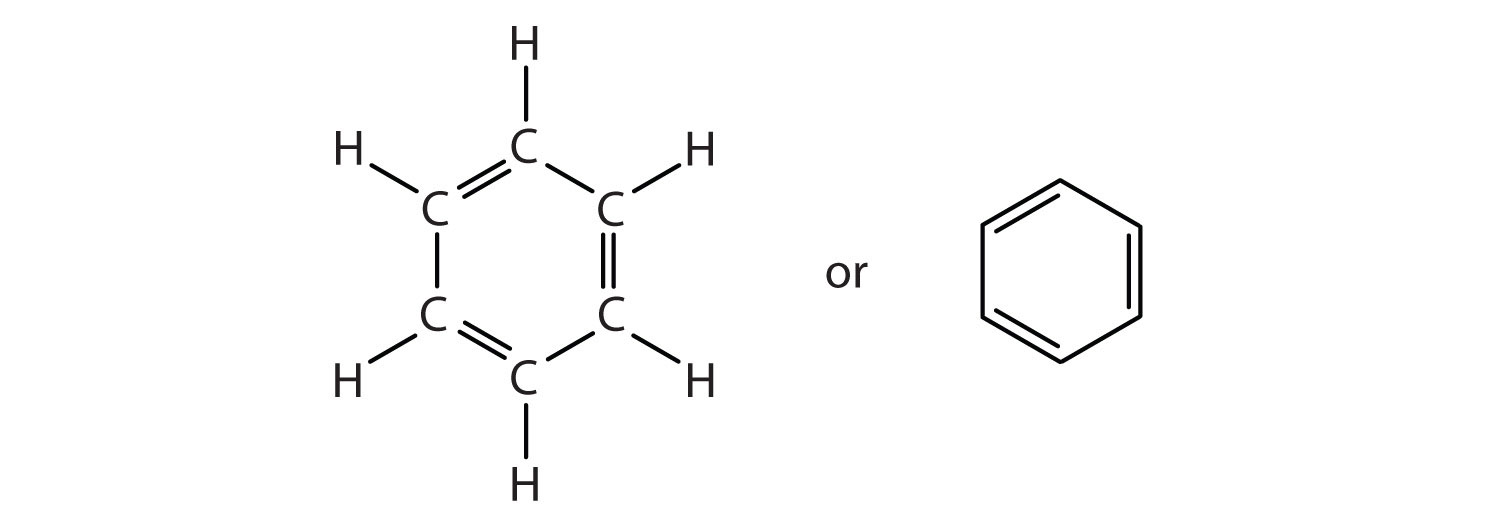
Tuttavia, queste strutture non spiegano le proprietà uniche del benzene. Inoltre, prove sperimentali indicano che tutti i legami carbonio-carbonio nel benzene sono equivalenti e la molecola è insolitamente stabile. I chimici spesso rappresentano il benzene come un esagono con un cerchio inscritto:
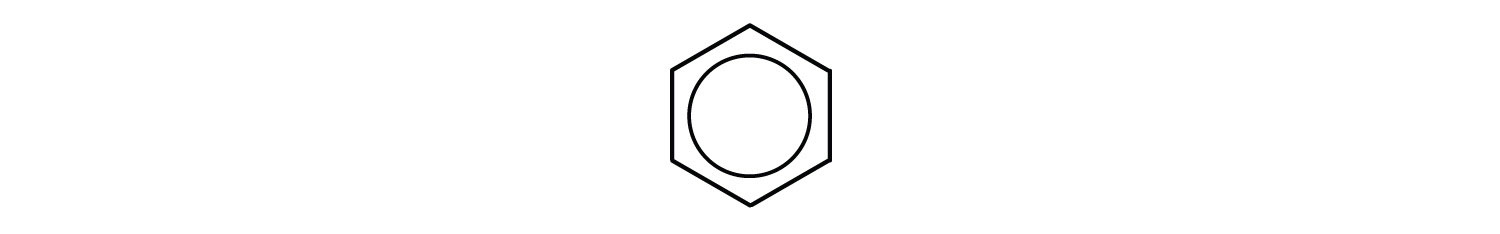
Il cerchio interno indica che gli elettroni di valenza sono condivisi equamente da tutti e sei gli atomi di carbonio (cioè, gli elettroni sono delocalizzati, o sparsi, su tutti gli atomi di carbonio). Resta inteso che ogni angolo dell’esagono è occupato da un atomo di carbonio e ogni atomo di carbonio ha un atomo di idrogeno collegato ad esso. Qualsiasi altro atomo o gruppo di atomi sostituito da un atomo di idrogeno deve essere mostrato legato a un particolare angolo dell’esagono. Usiamo questo simbolismo moderno, ma molti scienziati usano ancora la struttura precedente con legami doppi e singoli alternativi.
Per la tua salute: Benzene e Us
La maggior parte del benzene usato commercialmente proviene dal petrolio. Viene impiegato come materiale di partenza per la produzione di detergenti, farmaci, coloranti, insetticidi e materie plastiche. Una volta ampiamente usato come solvente organico, il benzene è ora noto per avere effetti tossici a breve ea lungo termine. L’inalazione di grandi concentrazioni può causare nausea e persino morte a causa di insufficienza respiratoria o cardiaca, mentre l’esposizione ripetuta porta a una malattia progressiva in cui la capacità del midollo osseo di produrre nuove cellule del sangue viene infine distrutta. Ciò si traduce in una condizione chiamata anemia aplastica, in cui vi è una diminuzione del numero di globuli rossi e bianchi.
Esercizi di revisione del concetto
- In che modo le reazioni tipiche del benzene differiscono da quelle degli alcheni?
- Descrivere brevemente il legame in benzene.
- Cosa significa il cerchio nella rappresentazione del benzene da parte del chimico?
Risposte
- Il benzene è piuttosto poco reattivo verso le reazioni di addizione rispetto ad un alchene.
- Gli elettroni di valenza sono condivisi equamente da tutti e sei gli atomi di carbonio (cioè gli elettroni sono delocalizzati).
- I sei elettroni sono condivisi equamente da tutti e sei gli atomi di carbonio.
Key Takeaway
- Gli idrocarburi aromatici sembrano insaturi, ma hanno un tipo speciale di legame e non subiscono reazioni di addizione.
Esercizi
- Disegna la struttura del benzene come se avesse legami singoli e doppi alternati.
- Disegna la struttura del benzene come i chimici di solito lo rappresentano oggi.

Leave a Reply