1.14: Distinguere tra pH e pKa
Acidità relativa e valori pKa
Un’applicazione dell’equazione di Henderson-Hasselbach è la capacità di determinare l’acidità relativa dei composti confrontando i loro valori pKa. Più forte è un acido, maggiore è la ionizzazione, minore è il pKa e minore è il pH che il composto produrrà in soluzione. Alcuni valori pKa selezionati per i composti nello studio della chimica organica sono mostrati di seguito. Poiché le reazioni organiche possono essere eseguite in ambienti non acquosi, il pH può superare 14 e i composti organici possono avere valori di pKa superiori a 16. Si tratta di una variazione su quella linea dal Mago di Oz, “Non viviamo più in acqua.”





È un’ottima idea impegnare in memoria gli intervalli approssimativi di pKa dei composti sopra. Una parola di cautela: quando si utilizza la tabella pKa, essere assolutamente sicuri di considerare la coppia acido/base coniugata corretta. Se ti viene chiesto di dire qualcosa sulla basicità dell’ammoniaca (NH3) rispetto a quella dello eth etossido (CH3CH2O-), ad esempio, i valori pKa rilevanti da considerare sono 9.2 (il pKa dello ion ammonio) e 16 (il pKa dell’etanolo). Da questi numeri, sai che l’etossido è la base più forte. Non commettere l’errore di usare il valore pKa di 38: questo è il pKa dell’ammoniaca che agisce come un acido e ti dice quanto è fondamentale lo ion NH2 (molto semplice!)
* Una nota sul pKa dell’acqua: Il pKa di acqua è 14. I testi di biochimica e chimica organica spesso elencano il valore come 15.7. Questi testi hanno erroneamente preso in considerazione il valore molare per la concentrazione dell’acqua nella costante di equilibrio. La corretta derivazione della costante di equilibrio comporta l’attività dell’acqua, che ha un valore di 1.
Esempio
Mentre questo corso inizia con singoli gruppi funzionali, alla fine lavoreremo con composti interessanti contenenti più gruppi funzionali. Riconoscere quali idrogeni possono essere ionizzati come protoni acidi e quali idrogeni NON possono, è un’abilità utile. Si noti in questo esempio che dobbiamo valutare l’acidità potenziale in quattro diverse posizioni sulla molecola.
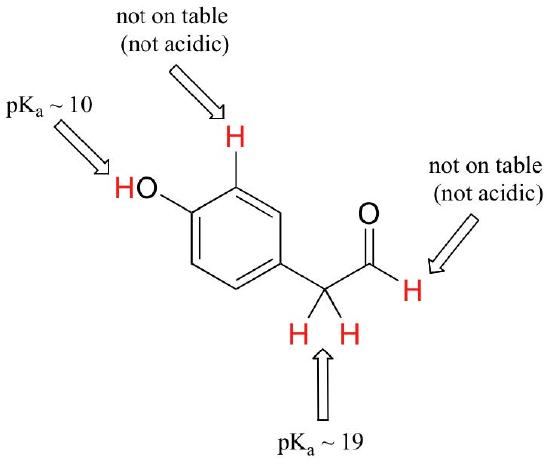
L’aldeide e i protoni aromatici non sono affatto acidi (i pKavalues sono superiori a 40 – non sul nostro tavolo). I due protoni sul carbonio accanto al carbonile sono leggermente acidi, con valori di pKa intorno a 19-20 secondo la tabella. Il protone più acido è sul gruppo fenolico, quindi se il composto dovesse essere sottoposto a un singolo equivalente molare di base forte, questo è il protone che verrebbe donato.
Acido& Ambienti di base – Tutto è relativo in reattività
Poiché il nostro obiettivo è comprendere la reattività chimica dinamica, NON è necessario conoscere la quantità specifica delle forme protonate e non protonate di un composto. Abbiamo semplicemente bisogno di sapere quale forma è predominante. Quando il pH dell’ambiente è inferiore al pKa del composto, l’ambiente è considerato acido e il composto esisterà prevalentemente nella sua forma protonata. Quando il pH dell’ambiente è maggiore del pKa del composto, l’ambiente è considerato fondamentale e il composto esisterà prevalentemente nella sua forma deprotonata.
Ad esempio, il pKa dell’acido acetico è di circa 5. A un pH di 1, l’ambiente è considerato acido e l’acido acetico esiste prevalentemente nella sua forma protonata. A pH 8, l’ambiente è considerato basico e l’acido acetico viene deprotonato per formare acetato (CH3CO2-). Al contrario, il pKa di fenolo è 10. A pH 8, l’ambiente è considerato acido per il fenolo e rimane principalmente protonato.
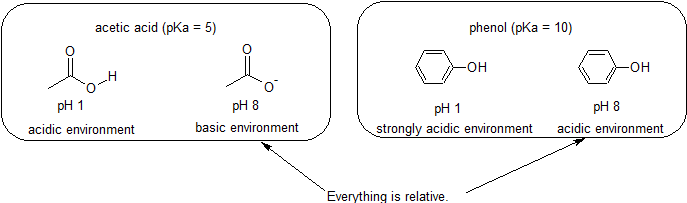
È anche importante ricordare che la chimica organica NON deve verificarsi nell’acqua, quindi i valori pKa possono arrivare fino a 50.
Esercizio
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
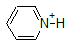 |
 |
 |
 |
 |
 |
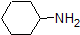 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply