Comparaison des concentrations d’Oxydants et de Réducteurs
Objectifs d’apprentissage
- Identifier comment visualiser les Potentiels de réduction standard du point de vue des agents réducteurs et oxydants viables dans les réactions REDOX.
Nous pouvons mesurer les potentiels standard pour une grande variété de substances chimiques, dont certaines sont énumérées dans le tableau P2. Ces données nous permettent de comparer les forces oxydatives et réductrices d’une variété de substances. La demi-réaction pour l’électrode à hydrogène standard (SHE) se situe à plus de la moitié de la liste dans le tableau \(\PageIndex{1}\). Tous les réactifs qui se trouvent en dessous de la SHE dans le tableau sont des oxydants plus forts que H +, et tous ceux qui se trouvent au-dessus de la SHE sont plus faibles. L’oxydant le plus fort du tableau est F2, avec un potentiel d’électrode standard de 2,87 V. Cette valeur élevée est compatible avec la forte électronégativité du fluor et nous indique que le fluor a une plus forte tendance à accepter les électrons (c’est un oxydant plus fort) que tout autre élément.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g)+2e−\(\rightleftharpoons\)2F−(aq) | 2.87 |
Tous les oxydants et réducteurs ne sont pas créés égaux. Les potentiels de réduction standard dans le tableau \(\PageIndex{1}\) peuvent être interprétés comme un classement des substances en fonction de leur pouvoir oxydant et réducteur. Les agents oxydants forts sont généralement des composés avec des éléments dans des états d’oxydation élevés ou avec une électronégativité élevée, qui gagnent des électrons dans la réaction redox (Figure \(\PageIndex{1}\)). Des exemples d’oxydants puissants comprennent le peroxyde d’hydrogène, le permanganate et le tétroxyde d’osmium. Les agents réducteurs sont généralement des éléments électropositifs tels que l’hydrogène, le lithium, le sodium, le fer et l’aluminium, qui perdent des électrons dans les réactions redox. Les hydrures (composés contenant de l’hydrogène à l’état d’oxydation formel -1), tels que l’hydrure de sodium, le borohydrure de sodium et l’hydrure de lithium-aluminium, sont souvent utilisés comme agents réducteurs dans les réactions organiques et organométalliques.
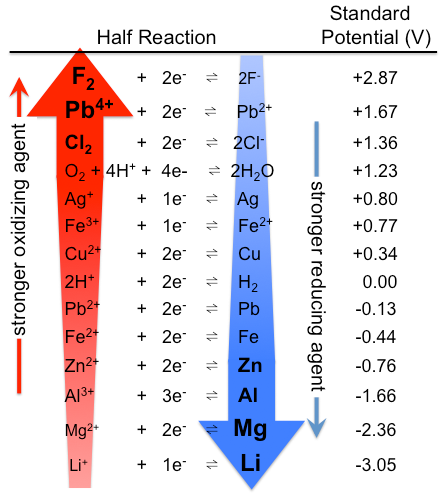
Figure\(\PageIndex{1}\): Tableau des potentiels d’électrodes standard. Notez que le classement est le contraire ici, avec des agents oxydants forts en haut et des agents réducteurs forts en bas, que dans le tableau \(\PageIndex{1}\). Les potentiels actuellement standard sont les mêmes bien sûr. (CC BY-SA 3.0; Tem5psu).
De même, toutes les espèces de la table \(\PageIndex{1}\) situées au-dessus de H2 sont des réducteurs plus forts que H2, et celles situées en dessous de H2 sont plus faibles. Le réducteur le plus puissant du tableau est donc le lithium métallique, avec un potentiel d’électrode standard de -3,04 V. Ce fait peut être surprenant car le césium, et non le lithium, est l’élément le moins électronégatif. L’anomalie apparente peut s’expliquer par le fait que les potentiels d’électrode sont mesurés en solution aqueuse, où les interactions intermoléculaires sont importantes, tandis que les potentiels d’ionisation et les affinités électroniques sont mesurés en phase gazeuse. En raison de sa petite taille, l’ion Li + est stabilisé en solution aqueuse par de fortes interactions électrostatiques avec l’extrémité dipolaire négative des molécules d’eau. Ces interactions entraînent une ΔHhydration significativement plus grande pour Li+ par rapport à Cs+. Le lithium métal est donc le réducteur le plus puissant (le plus facilement oxydé) des métaux alcalins en solution aqueuse.
Les potentiels de réduction standard peuvent être interprétés comme un classement des substances en fonction de leur pouvoir oxydant et réducteur. Les espèces du tableau \(\PageIndex{1}\) situées au-dessus de H2 sont des agents réducteurs plus puissants (plus facilement oxydables) que H2. Les espèces situées en dessous de H2 sont des agents oxydants plus puissants.
Parce que les demi-réactions indiquées dans le tableau \(\PageIndex{1}\) sont classées par ordre de leurs valeurs E°, nous pouvons utiliser le tableau pour prédire rapidement les forces relatives de divers oxydants et réducteurs. Toute espèce du côté gauche d’une demi-réaction oxydera spontanément toute espèce du côté droit d’une autre demi-réaction qui se trouve en dessous dans le tableau. Inversement, toute espèce du côté droit d’une demi-réaction réduira spontanément toute espèce du côté gauche d’une autre demi-réaction qui se trouve au-dessus dans le tableau. Nous pouvons utiliser ces généralisations pour prédire la spontanéité d’une grande variété de réactions redox (cellule E° >0), comme illustré dans l’exemple \(\PageIndex{1}\).
Exemple \(\PageIndex{1}\): Sulfure d’argent
La ternissure noire qui se forme sur les objets en argent est principalement Ag2S. La demi-réaction pour inverser le processus de ternissement est la suivante:
- En se référant à la table \(\PageIndex{1}\), prédisez quelles espèces — H2O2(aq), Zn(s), I−(aq), Sn2+(aq) — peuvent réduire Ag2S en Ag dans des conditions standard.
- De ces espèces — H2O2 (aq), Zn(s), I− (aq), Sn2+ (aq), identifient quel est l’agent réducteur le plus puissant en solution aqueuse et donc le meilleur candidat pour un produit commercial.
- À partir des données du tableau \(\PageIndex{1}\), suggérez un agent réducteur alternatif facilement disponible, peu coûteux et peut-être plus efficace pour éliminer le ternissement.

Donné: demi-réaction de réduction, potentiel d’électrode standard et liste des réducteurs possibles
Demandé: réducteurs pour Ag2S, réducteur le plus fort et agent réducteur potentiel pour éliminer le ternissement
Stratégie:
A De leurs positions dans le tableau \(\PageIndex{1}\), décidez quelles espèces peuvent réduire Ag2S. Déterminez quelle espèce est le réducteur le plus fort.
B Utilisez la table \(\PageIndex{1}\) pour identifier un réducteur pour Ag2S qui est un produit domestique courant.
Solution
Nous pouvons résoudre le problème de deux manières: (1) comparez les positions relatives des quatre réducteurs possibles avec celle du couple Ag2S/Ag dans le tableau \(\PageIndex{1}\) ou (2) comparez E° pour chaque espèce avec E° pour le couple Ag2S/Ag (-0,69 V).
- A Les espèces de la table \(\PageIndex{1}\) sont disposées de haut en bas dans l’ordre d’augmentation de la force réductrice. Des quatre espèces données dans le problème, I− (aq), Sn2+ (aq) et H2O2 (aq) se trouvent au-dessus d’Ag2S, et une se trouve en dessous. Nous pouvons donc conclure que Zn(s) peut réduire Ag2S(s) dans des conditions standard, alors que I−(aq), Sn2+ (aq) et H2O2 (aq) ne le peuvent pas. Sn2+ (aq) et H2O2 (aq) apparaissent deux fois dans le tableau : du côté gauche (oxydant) dans une demi-réaction et du côté droit (réducteur) dans une autre.
- Le réducteur le plus puissant est Zn(s), l’espèce du côté droit de la demi-réaction qui se trouve plus près du bas du tableau \(\PageIndex{1}\) que les demi-réactions impliquant I−(aq), Sn2+ (aq) et H2O2(aq). (Les produits commerciaux qui utilisent un morceau de zinc sont souvent commercialisés comme un « produit miracle” pour éliminer le ternissement de l’argent. Tout ce qui est nécessaire est d’ajouter de l’eau chaude et du sel pour la conductivité électrique.)
- B Parmi les réducteurs qui se trouvent en dessous de Zn(s) dans le tableau \(\PageIndex{1}\), et qui sont donc des réducteurs plus forts, un seul est couramment disponible dans les produits ménagers: Al(s), qui est vendu sous forme de papier d’aluminium pour l’emballage des aliments.
Exemple \(\PageIndex{2}\):
Utilisez les données du tableau \(\PageIndex{1}\) pour déterminer si chaque réaction est susceptible de se produire spontanément dans des conditions standard :
- Sn(s) + Be2+(aq) → Sn2+(aq) +Be(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2 +(aq) + 2H2O(l)
Donné: réaction redox et liste des potentiels d’électrode standard (tableau P2)
Demandé: spontanéité de réaction
Stratégie:
- Identifiez les demi-réactions dans chaque équation. À l’aide de la table \(\PageIndex{1}\), déterminez les potentiels standard pour les demi-réactions dans la direction appropriée.
- Utilisez l’équation \(E_{cell}= E^o_{srp}(cathode) – E^o_{srp}(anode)\) pour calculer le potentiel de cellule standard pour la réaction globale. À partir de cette valeur, déterminez si la réaction globale est spontanée.
Solution
- Un étain métallique est oxydé en Sn2+ (aq) et le Be2+ (aq) est réduit en béryllium élémentaire. On peut trouver les potentiels d’électrode standard pour cette dernière demi-réaction (réduction) (-1.85 V) et pour la première demi-réaction (oxydation) (-0,14 V) directement à partir de la table \(\PageIndex{1}\).
B L’addition des deux demi-réactions donne la réaction globale :
|
\(\textrm{cathode: }\;\mathrm{Be^{2+}( si vous avez des questions, n’hésitez pas à nous contacter si vous avez des questions ou si vous avez des questions ou si vous avez des questions ou si vous avez des questions ou si vous avez des questions, veuillez nous contacter pour plus d’informations. \; \mathrm{Sn(s)+ \mathrm{Be^{2+}(aq)}\rightarrow\mathrm{Sn^{2+}}(aq)}+\mathrm{Be(s)}\) |
\(E^\circ_{\textrm{cathode}} =\textrm{-1.99V}\\E^\circ_{\textrm{anode}} = \textrm{-1.99V}\\E ^\circ_{\textrm{anode}}= \textrm{ -0.14 V}\\E^\circ_ {\textrm{cell}} = E ^\circ_{\textrm{cathode}} – E^\circ_{\textrm{anode}}\\\hspace{5mm}= -\textrm{1.85 V}\) |
Le potentiel cellulaire standard est assez négatif, de sorte que la réaction ne se produira pas spontanément comme écrit. Autrement dit, l’étain métallique ne peut pas réduire le Be2+ en métal au béryllium dans des conditions standard. Au lieu de cela, le processus inverse, la réduction des ions stanneux (Sn2 +) par le béryllium métallique, qui a une valeur positive de cellule E °, se produira spontanément.
- Un MnO2 est l’oxydant (Mn4+ est réduit à Mn2+), tandis que H2O2 est le réducteur (O2− est oxydé en O2). On peut obtenir les potentiels d’électrode standard pour les demi-réactions de réduction et d’oxydation directement à partir du tableau \(\PageIndex{1}\).
B Les deux demi-réactions et leurs potentiels correspondants sont les suivants:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V}\\E ^\circ_{\textrm{anode}} =\textrm{0.70 V} \\E^\circ_{\textrm{cell}} = E ^\circ_{\textrm{cathode}} – E ^\circ_{\textrm{anode}}\\\hspace{5mm} =-\textrm{0.53 V}\) |
Le potentiel standard de la réaction est positif, ce qui indique que dans des conditions standard, elle se produira spontanément comme écrit. Le peroxyde d’hydrogène réduira le MnO2 et l’oxygène gazeux évoluera à partir de la solution.
Exercice \(\PageIndex{2}\)
Utilisez les données du tableau \(\PageIndex{1}\) pour déterminer si chaque réaction est susceptible de se produire spontanément dans des conditions standard:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4OH−(aq) → 4MnO4−(aq) + 2H2O
Réponse
- spontanée (cellule E° = 0,36 V)
- non spontanée (cellule E° = -0.20 V)
Bien que le signe de cellule E ° nous indique si une réaction redox particulière se produira spontanément dans des conditions standard, il ne nous indique pas dans quelle mesure la réaction se déroule, et il ne nous dit pas ce qui se passera dans des conditions non standard. Répondre à ces questions nécessite une compréhension plus quantitative de la relation entre le potentiel des cellules électrochimiques et la thermodynamique chimique.
Résumé
Les teneurs relatives de divers oxydants et réducteurs peuvent être prédites à l’aide des valeurs de E°. Les forces oxydatives et réductrices d’une variété de substances peuvent être comparées à l’aide de potentiels d’électrodes standard. Les anomalies apparentes peuvent s’expliquer par le fait que les potentiels d’électrodes sont mesurés en solution aqueuse, ce qui permet de fortes interactions électrostatiques intermoléculaires, et non en phase gazeuse.
Problèmes conceptuels
- L’ordre des potentiels d’électrode ne peut pas toujours être prédit par les potentiels d’ionisation et les affinités électroniques. Pourquoi? Vous attendez-vous à ce que le métal sodique ait un potentiel d’électrode plus ou moins élevé que prévu à partir de son potentiel d’ionisation? Quel est son potentiel d’électrode approximatif?
- Sans se référer aux données tabulées, de Br2 / Br−, Ca2+ /Ca, O2/ OH- et Al3+/Al, lequel vous attendez-vous à avoir le potentiel d’électrode le moins négatif et lequel le plus négatif? Pourquoi?
- En raison des acides aminés soufrés présents dans les blancs d’œufs, manger des œufs avec une fourchette en argent ternira la fourchette. En tant que chimiste, vous avez toutes sortes de produits de nettoyage intéressants dans votre armoire, y compris une solution d’acide oxalique à 1 M (H2C2O4). Choisiriez-vous cette solution pour nettoyer la fourchette que vous avez ternie en mangeant des œufs brouillés?
- Le potentiel d’électrode pour la réaction Cu2+(aq) + 2e− → Cu(s) est de 0,34 V dans les conditions standard. Le potentiel d’oxydation de 0,5 mole de Cu est-il égal à -0,34/2 V ? Expliquez votre réponse.
- Reportez—vous à la table \(\PageIndex{1}\) pour prédire
- Quelles espèces − Sn4+(aq), Cl—(aq), Ag+(aq), Cr3+(aq) et/ ou H2O2(aq) − peuvent oxyder MnO2(s) en MNO4 – dans des conditions standard.
- Quelle espèce – Sn4+ (aq), Cl− (aq), Ag+ (aq), Cr3+ (aq) et / ou H2O2 (aq) — est l’agent oxydant le plus puissant en solution aqueuse.
Réponse conceptuelle
- Non; E°= -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply