Épigénétique – Ce ne sont pas seulement les gènes qui font de nous
Alors qu’est-ce que l’épigénétique?
Une autre façon de voir l’épigénétique est la suivante: alors que la génétique traditionnelle décrit la façon dont les séquences d’ADN de nos gènes sont transmises d’une génération à l’autre, l’épigénétique décrit la façon dont les gènes sont utilisés. Pour faire une analogie informatique, considérez l’épigénétique comme des métadonnées, des informations décrivant et ordonnant les données sous-jacentes. Si vous possédez un lecteur MP3 par exemple, il contiendra beaucoup de données, les fichiers MP3. Considérez-les comme analogues aux gènes. Mais vous aurez aussi probablement des listes de lecture ou vous pourrez jouer des morceaux par artiste ou genre. Cette information, playlist, artiste, genre, etc. est des métadonnées. Il détermine quelles pistes sont jouées et dans quel ordre, et c’est ce que l’épigénétique est à la génétique. C’est un ensemble de processus qui affecte les gènes activés, ou « exprimés”, comme diraient les biologistes moléculaires.
Comment fonctionne l’épigénétique ?
L’épigénétique concerne donc la façon dont les gènes sont exprimés et utilisés, plutôt que la séquence d’ADN des gènes eux-mêmes, mais comment cela fonctionne-t-il? De nombreux chercheurs ont étudié l’épigénétique au cours des dernières décennies, et c’est actuellement un domaine d’activité de recherche intense. Nous savons qu’une partie du fonctionnement de l’épigénétique consiste à ajouter et à enlever de petites étiquettes chimiques à l’ADN. Vous pouvez considérer ces balises comme des notes post-it qui mettent en évidence des gènes particuliers avec des informations indiquant s’ils doivent être activés ou désactivés. En fait, l’étiquette chimique en question est appelée groupe méthyle (voir schéma 1) et elle sert à modifier l’une des quatre bases ou « lettres chimiques”, A, C, T et G, qui constituent le code génétique de notre ADN. La lettre qui est marquée est C ou cytosine et lorsqu’elle est modifiée ou méthylée, elle est appelée cytosine 5-méthyle. Des groupes méthyle sont ajoutés à l’ADN par des enzymes appelées ADN méthyl transférases (DNMT).
-
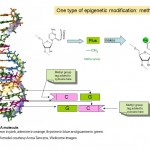
Diagramme 1. Deux marqueurs chimiques, les groupes méthyle et acétyle, qui sont au cœur des phénomènes épigénétiques et de la structure chimique de la cytosine et de la cytosine 5-méthyle dans l’ADN. La partie pentagonale de la molécule forme le « squelette » continu de l’ADN. Un seul des deux brins d’ADN qui composent la double hélice familière est montré.
Le statut de reine des abeilles est en partie déterminé par moins de marqueurs méthyliques
Dans la plupart des cas, plus de Cs méthylés dans l’ADN d’un gène entraînent la désactivation du gène. Les abeilles nous fournissent un bon exemple de la façon dont cela peut fonctionner. Les abeilles ouvrières et la reine ont des corps très différents; la reine est beaucoup plus grande, vit plus longtemps, a un abdomen élargi et pond plusieurs milliers d’œufs, tandis que les ouvrières plus petites sont stériles mais ont des compétences complexes en matière de recherche de nourriture et de communication. Malgré cela, la reine et les ouvrières d’une ruche sont des femelles et génétiquement identiques. L’indice de la façon dont cela se produit réside dans la gelée royale, une sécrétion qui est nourrie à certaines larves en développement, et qui fait que ces larves deviennent des reines plutôt que des ouvrières. Nous reviendrons plus tard sur la gelée royale et ses propriétés de fabrication de reines, mais une recherche fascinante a montré que si la quantité du groupe méthyle ajoutant l’enzyme DNMT était artificiellement réduite chez les larves d’abeilles, les larves se développaient en reines, même si elles n’étaient pas nourries à la gelée royale. Ainsi, le passage entre la reine et la travailleuse peut être inversé par l’abondance de marqueurs méthyliques sur l’ADN des larves d’abeilles. Moins de marqueurs méthyliques entraînent l’activation d’un ou de plusieurs gènes spéciaux chez les larves en développement, ce qui entraîne le développement des larves en reines et non en ouvrières.
Les étiquettes sur les queues actionnent également des commutateurs géniques
Les étiquettes de méthyle de l’ADN ne sont cependant qu’une partie de l’histoire. Dans les cellules de toutes les plantes et de tous les animaux, l’ADN est emballé ou enveloppé dans des nucléosomes où la double hélice d’ADN est enroulée autour d’un noyau central de protéines (voir Schéma 2). Environ 150 lettres d’ADN (ou paires de bases) sont enroulées autour de chaque nucléosome, ce qui permet d’emballer les 3 milliards de paires de bases de code génétique dans chacune de nos cellules. Les nucléosomes sont trop petits pour être vus à l’aide de microscopes conventionnels, mais les biologistes utilisent une technique appelée diffraction des rayons X pour déterminer la forme et l’organisation d’objets comme les nucléosomes, et en 1997, cette technique a révélé la belle structure des nucléosomes à haute résolution – voir (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
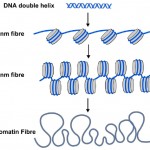
Diagramme 2. La double hélice d’ADN familière (bleue) est enroulée autour des nucléosomes (cylindres gris) dans les cellules. La chaîne de nucléosomes peut être enroulée en un filament plus épais, appelé fibre de 30 nm, et cela peut être encore enroulé en une fibre de chromatine encore plus épaisse. Lorsque les gènes sont allumés, leurs nucléosomes sont plus enroulés comme la fibre 10 nm.
Les nucléosomes sont compacts, mais les extrémités ou « queues » des protéines qui composent le nucléosome, appelées histones, dépassent de la structure du nucléosome autrement compacte. Comme les marqueurs méthyliques sur l’ADN, de petites marqueurs chimiques peuvent également être ajoutés à ces queues d’histones (voir Schéma 3). Deux des étiquettes chimiques ajoutées à ces queues sont des groupes acétyle et des groupes méthyle. Méthyle, acétyle et quelques autres types d’étiquettes peuvent être ajoutés aux queues dans un grand nombre de combinaisons et cela affecte si un gène sous-jacent est activé ou désactivé. En fait, les gènes peuvent être désactivés immédiatement (c’est ce qu’on appelle le silençage), complètement allumés ou quelque part entre les deux par des étiquettes de méthyle d’ADN et des étiquettes de queue d’histone. La combinaison d’étiquettes d’ADN et d’histones peut également avoir un effet sur la facilité avec laquelle un gène est activé ou désactivé.
-
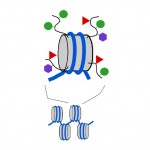
Diagramme 3. Des étiquettes chimiques peuvent être ajoutées aux « queues » des protéines histones qui composent les nucléosomes. Cylindre gris, nucléosome; lignes noires incurvées, queues d’histones; cercles verts, étiquettes de méthyle; triangles rouges, étiquettes d’acétyle; hexagones mauves, autres types d’étiquettes.
Lorsque les cellules se divisent
Lorsque les cellules se divisent, toute la séquence d’ADN de la cellule d’origine (3 milliards de paires de bases contenues dans 23 paires de chromosomes dans une cellule humaine) est dupliquée de sorte que les deux cellules filles reçoivent une copie exacte. Qu’arrive-t-il à toutes ces étiquettes épigénétiques ? Nous savons depuis un certain temps que les étiquettes ADN-méthyle sont également copiées, de sorte que les deux cellules filles ont le même modèle de méthylation de l’ADN. Nous savons maintenant que le motif des étiquettes d’histones est également principalement dupliqué lorsque les cellules se divisent, bien que cela soit actuellement moins bien compris. Néanmoins, la division cellulaire est également un moment où les étiquettes épigénétiques peuvent le plus facilement être modifiées.
Retour du ver à longue durée de vie
Dès le début, nous sommes tombés sur l’histoire des vers microscopiques à longue durée de vie quipassé sur leur longévité à leur progéniture même si la progéniture individuelle n’héritait pas du gène variant (mutation) à l’origine de la durée de vie prolongée. Nous sommes maintenant en mesure d’expliquer ce résultat apparemment étrange. Dans la plupart des cas, les gènes contiennent les informations nécessaires à la fabrication d’une molécule protéique, et les molécules protéiques peuvent être des enzymes qui effectuent des réactions chimiques dans la cellule ou des parties de la structure de la cellule elle-même. Il s’avère que les gènes qui ont été mutés dans l’étude sur les vers fabriquent des protéines qui travaillent ensemble pour ajouter une étiquette méthylique aux nucléosomes. Cette balise est un interrupteur. Lorsqu’un ou plusieurs des gènes ont été mutés, cette étiquette était absente et plusieurs gènes qui devaient être activés, y compris certains impliqués dans le vieillissement, étaient désactivés et les vers avaient une durée de vie plus longue. Ce qui est inattendu, c’est que l’on pensait que les étiquettes épigénétiques étaient complètement effacées ou réinitialisées lors de la formation du sperme et de l’ovule, et que contrairement aux gènes eux-mêmes, elles ne devraient pas être transmises à la génération suivante. Mais ce résultat et d’autres recherches qui montrent que ce n’est pas toujours le cas et que parfois, le modèle des étiquettes épigénétiques est transmis.
Comment faire une reine
Qu’une abeille larvaire devienne une ouvrière ou une reine dépend d’un commutateur épigénétique, et cet interrupteur semble être « renversé » par la gelée royale. Mais qu’en est-il de la gelée royale qui conduit une larve qui, autrement, grandirait pour devenir ouvrière, pour devenir reine? La réponse réside dans la compréhension que les étiquettes chimiques individuelles qui sont ajoutées aux queues d’histones des nucléosomes sont constamment révisées par la cellule. Les marqueurs acétyliques sont ajoutés par des enzymes appelées histones acétyl transférases et ils sont éliminés ou effacés par un deuxième groupe d’enzymes appelées histones désacétylases (HDAC). Ces deux enzymes sont présentes dans la plupart des cellules, ce qui permet d’activer ou de désactiver les gènes au fil du temps.
D’autres étiquettes à acétyle aident à obtenir le statut de reine des abeilles
Récemment, des chercheurs ont entrepris d’identifier des composés dans la gelée royale qui pourraient modifier ce processus, et ce qu’ils ont trouvé était connu sous le nom d’inhibiteur de l’HDAC. Il s’agissait d’un composé chimique relativement simple présent dans la gelée royale et qui arrête l’action des enzymes HDAC qui éliminent normalement les marqueurs acétyl des histones. Il en résulte une accumulation de marqueurs acétyle dans les cellules des embryons d’abeilles, et comme la réduction des groupes ADN-méthyle décrite précédemment, on pense que cela active les gènes clés nécessaires au développement d’une reine. Sans l’inhibiteur HDAC dans la gelée royale, les larves suivent un ensemble d’instructions génétiques « par défaut » et se développent en ouvrières.
Les inhibiteurs de HDAC sont non seulement importants pour les reines, mais font également partie d’un nombre restreint mais croissant de médicaments médicalement utiles qui ciblent les étiquettes épigénétiques et qui sont utiles dans le traitement de certains types de cancer. De plus, les HDAC jouent également un rôle dans la façon dont notre cerveau forme des souvenirs, et de nouveaux médicaments qui affectent l’acétylation des histones pourraient jouer un rôle à l’avenir dans le traitement des troubles de la mémoire chez les patients âgés.
L’environnement et l’épigénétique
Nous avons vu comment la différence entre une reine et une abeille ouvrière est déterminée par l’exposition à un produit chimique qui modifie directement les balises épigénétiques telles que les groupes acétyle; mais existe-t-il des exemples où la nutrition ou d’autres aspects de l’environnement affectent les populations humaines d’une manière qui peut être expliquée par l’épigénétique? Évidemment, nous ne pouvons pas faire d’expériences sur des populations humaines comme nous le pouvons sur des vers microscopiques ou des abeilles, mais parfois l’histoire humaine ou les phénomènes naturels le font pour nous. Un tel exemple est ce que l’on appelle l’hiver hollandais de la faim. Au cours de la dernière année de la Seconde Guerre mondiale en Europe, un embargo alimentaire imposé par les forces allemandes d’occupation à la population civile des Pays-Bas a entraîné une grave famine, coïncidant avec un hiver particulièrement rigoureux. Environ 20 000 personnes sont mortes de faim alors que les rations tombaient en dessous de 1 000 kilocalories par jour. Malgré le chaos de la guerre, les soins médicaux et les dossiers sont restés intacts, permettant aux scientifiques d’étudier par la suite les effets de la famine sur la santé humaine. Ce qu’ils ont constaté, c’est que les enfants qui étaient dans l’utérus pendant la famine ont connu une augmentation à vie de leurs chances de développer divers problèmes de santé par rapport aux enfants conçus après la famine. La période la plus sensible à cet effet a été les premiers mois de la grossesse. Ainsi, quelque chose semble se produire au début du développement dans l’utérus qui peut affecter l’individu pour le reste de sa vie.
Les effets épigénétiques peuvent parfois passer aux petits-enfants
Encore plus surprenant, certaines données semblent suggérer que les petits-enfants de femmes enceintes pendant l’hiver de la faim subissent certains de ces effets. D’après ce que nous avons déjà discuté, cela suggère fortement un mécanisme épigénétique. En fait, la recherche avec les familles hollandaises d’hiver de la faim se poursuit, et une étude récente portant sur un gène IGF2 a révélé des niveaux inférieurs de l’étiquette méthylique dans l’ADN de ce gène chez les individus exposés à la famine avant la naissance. Bien que l’IGF2 ne soit pas elle-même impliquée dans le risque accru de mauvaise santé chez ces personnes, elle montre que les effets épigénétiques (c’est-à-dire la réduction du nombre de marqueurs méthyliques sur des gènes particuliers) produits avant la naissance peuvent durer plusieurs décennies. Des études chez l’animal ont également montré que le régime alimentaire de la mère peut avoir des effets sur sa progéniture. Par exemple, nourrir des moutons avec un régime qui ne contient pas les types de nourriture nécessaires à la fabrication de groupes méthyle conduit à une progéniture avec des modèles de méthylation de l’ADN modifiés et qui présente des taux de certains problèmes de santé plus élevés que prévu.
Épigénétique et impression, pourquoi les gènes de maman et de papa ne sont pas toujours équivalents
Nous avons tous 23 paires de chromosomes dans nos cellules. Pour chaque paire, un venait de la mère et un du père. Ainsi, nous héritons d’une copie de chaque gène de chaque parent et nous supposons généralement que la fonction du gène ne dépend pas de quel parent il provient. Cependant, pour les gènes imprimés, les choses sont différentes. Pour ces gènes, la copie maternelle ou paternelle du gène est active, tandis que l’autre est gardée silencieuse. Il existe au moins 80 gènes imprimés chez l’homme et la souris, dont beaucoup sont impliqués dans la croissance de l’embryon ou du placenta. Comment une copie d’un gène peut-elle être désactivée, tandis que l’autre copie de la même cellule est activée? La réponse est l’épigénétique. Le gène imprimé le plus étudié est probablement l’IGF2 (voir ci-dessus). Une partie de l’IGF2 fonctionne comme un commutateur. Si l’ADN est méthylé ici, le gène IGF2 peut être exprimé. Le commutateur n’est méthylé que dans la copie du gène de papa et donc seule cette copie est exprimée, tandis que la copie maternelle est silencieuse. On pense que ce commutateur est mis en place dans les gamètes (ovules et spermatozoïdes), de sorte que dès le début, les gènes reçus de maman et ceux de papa sont étiquetés différemment avec des étiquettes épigénétiques et ne sont donc pas équivalents.
Troubles de l’empreinte et troubles mentaux
Les syndromes d’Angelmann et de Prader-Willi sont deux affections génétiques distinctes avec des symptômes différents, tous deux causés par la perte d’une partie du chromosome 15. Les enfants qui héritent d’une copie de ce chromosome défectueux développent le syndrome d’Angelmann ou de Prader-Willi, bien qu’ils aient une copie normale du chromosome de leur autre parent. Alors, comment une même mutation (perte d’une partie du chromosome 15) conduit-elle à ces deux conditions différentes? La réponse réside dans la découverte que ce morceau particulier du chromosome 15 contient un certain nombre de gènes qui sont imprimés, de sorte que seule la copie paternelle ou maternelle de ces gènes est exprimée; lequel des deux syndromes apparaît dépend de si la délétion était dans le chromosome maternel ou hérité paternellement. Lorsque le chromosome défectueux est hérité de Papa, il n’y a pas de copie fonctionnelle des gènes imprimés qui sont désactivés sur le chromosome maternel 15 et le résultat est le syndrome d’Angelmann et vice versa pour le syndrome de Prader-Willi. Ceci est très différent de la plupart des maladies génétiques telles que la fibrose kystique, où un effet sur le développement ou la santé n’est observé que lorsqu’un gène ou des gènes mutés sont hérités des deux parents.
Garçons contre filles, comment éteindre un chromosome entier
Un peu de génétique que la plupart d’entre nous connaissent est ce qui fait d’un garçon un garçon et d’une fille une fille. Ce sont les chromosomes X et Y. Au tout début de notre existence, chacun de nous a reçu un chromosome X de nos mères via l’ovule, et tandis que les filles ont reçu un autre chromosome X de leurs pères, via le sperme, les garçons ont obtenu un chromosome Y. Le chromosome Y dans les cellules d’un embryon mâle le dirige vers un garçon, tandis qu’avec deux chromosomes X et aucun chromosome Y, l’embryon femelle se développe vers une fille. Maintenant, vous remarquerez peut-être qu’il y a un déséquilibre ici. Nous avons tous deux chacun des autres chromosomes, mais pour les chromosomes sexuels (X et Y), les filles ont deux Xs alors que les garçons n’ont qu’un X (et un Y). Alors que le chromosome Y contient peu de gènes, principalement impliqués dans la « masculinité”, le chromosome X contient pas mal de gènes impliqués dans des processus importants tels que la vision des couleurs, la coagulation du sang et la fonction musculaire. Afin d’égaliser le « dosage” des gènes du chromosome X entre les cellules mâles et femelles, un chromosome X entier est éteint dans les cellules femelles. C’est ce qu’on appelle l’inactivation du chromosome X et cela se produit très tôt dans l’utérus. Dans ce processus, les cellules éteignent au hasard le chromosome X paternel ou maternel, de sorte que lorsqu’une fille naît, son corps est un mélange ou une chimère de cellules où le chromosome X maternel ou paternel est éteint. La façon dont cela se produit implique le type de balises épigénétiques dont nous avons discuté et il est connu depuis des décennies que les cellules femelles contiennent un chromosome X très compact appelé le corps de Barr qui peut être vu au microscope, et c’est le chromosome X inactif.
Le cas du chat écaille de tortue
Nous connaissons probablement tous les chats écaille de tortue et leurs pelages tachetés avec des taches de fourrure orange et noire. Ce que vous ne savez peut-être pas, c’est que presque tous les chats avec ce type de pelage sont des femmes! La raison en est qu’un gène de la couleur du pelage est situé sur le chromosome X du chat. Il existe deux versions de ce gène, appelées « O » et ”o »; l’une donne de la fourrure de gingembre et l’autre noire. Deux copies de la même version chez une chatte donnent respectivement une fourrure de gingembre ou une fourrure noire, mais une copie de chacune donne un effet d’écaille de tortue. Ceci est dû à l’inactivation du chromosome X. La peau de ces chats est composée de plaques de cellules où le chromosome X maternel ou paternel est inactivé. Il en résulte une peau avec le gène O activé et o réduit au silence dans certaines taches (fourrure orange) et le gène O activé et O réduit au silence dans d’autres taches (fourrure noire), d’où le motif en écaille de tortue. Comme les chats mâles n’ont qu’un seul chromosome X et aucune inactivation du chromosome X, ils sont soit orange, soit noirs partout.
Héritage épigénétique, les états épigénétiques peuvent-ils être transmis d’une génération à l’autre ?
Comme nous l’avons vu dans l’exemple du ver rond, les effets épigénétiques (dans ce cas une durée de vie prolongée) peuvent parfois être transmis d’une génération à l’autre, bien que les effets ne semblent durer que quelques générations. Existe-t-il des exemples où les effets épigénétiques se répercutent sur les générations suivantes chez l’homme ou d’autres mammifères? Il existe des preuves que les effets de l’hiver de la faim aux Pays-Bas ont affecté les petits-enfants des femmes enceintes pendant la famine. De même, dans une étude sur une population du nord de la Suède du 19ème siècle qui a subi des cycles de famine et d’abondance, la quantité de nourriture disponible semble avoir affecté la santé et la longévité de la génération suivante.
La couleur des cheveux chez la souris peut être déterminée par un effet épigénétique
L’exemple le plus connu d’effets épigénétiques transgénérationnels est peut-être fourni par le gène Agouti de la souris. Ce gène contrôle la couleur des cheveux et est activé au bon moment dans les cellules du follicule pileux pour produire une bande jaune dans les poils autrement sombres, ce qui donne ce qu’on appelle un pelage agouti. Mais les souris avec une variante particulière du gène Agouti appelée Avy ont des pelages qui se situent entre le jaune et le motif foncé normal (agouti) des souris de type sauvage. Les souris jaunes deviennent également obèses et souffrent d’autres problèmes de santé. Le gène Avy semble donc avoir un effet variable (en fait, Avy signifie jaune Avariable). Comment cela fonctionne a intrigué les généticiens pendant des années, mais nous pouvons maintenant reconnaître cela comme un effet épigénétique. La fourrure jaune se produit parce que la version Avy du gène Agouti a des contrôles défectueux et est allumée tout le temps. Cependant, des marqueurs méthyliques sont souvent ajoutés à la séquence d’ADN témoin défectueuse, ce qui a tendance à désactiver le gène, ce qui entraîne une fourrure agouti tachetée ou foncée chez les souris individuelles. Les petits nés de mères portant le gène Avy ont une couleur allant du jaune au foncé, mais la proportion dépend de la couleur du pelage de la mère; les portées des femelles foncées (agouti) sont plus susceptibles de contenir des petits foncés. De plus, une proportion plus élevée de descendants sombres est observée si la mère et la grand-mère ont la coloration sombre. Ainsi, la coloration de l’agouti, qui est déterminée épigénétiquement (par le nombre de marqueurs méthyliques sur le gène Avy) peut dans une certaine mesure se poursuivre d’une génération à l’autre.
Les ovules et les spermatozoïdes n’ont généralement pas d’effets épigénétiques
Bien que nous puissions trouver des cas où les effets épigénétiques durent apparemment des parents à la progéniture, ce n’est généralement pas le cas et presque tous les interrupteurs ou marques épigénétiques sont réinitialisés dans les cellules germinales (ovules et spermatozoïdes) et dans les tout premiers stades de développement d’un embryon. En fait, si ce n’était pas le cas, le développement étonnant d’un ovule fécondé en une créature entièrement formée serait impossible.
Passer d’un ovule fécondé à un humain complètement formé, tout est dans le génome (épi)
Jusqu’à présent, nous avons décrit quelques cas spécifiques de régulation épigénétique, mais nous savons maintenant que l’épigénétique dans son sens large, (comment les gènes sont exprimés et utilisés, plutôt que la séquence d’ADN des gènes eux-mêmes) est au cœur de la façon dont un ovule fécondé peut éventuellement donner naissance à un organisme entier et comment les cellules, disons de votre peau, restent des cellules de la peau et sont différentes de celles de votre cerveau, bien qu’elles contiennent exactement les mêmes gènes. Peu de temps après la fécondation, un embryon humain en développement est constitué d’une boule de cellules appelées cellules souches embryonnaires. Chacune de ces cellules a la capacité de donner naissance à l’un des types de cellules du corps au fur et à mesure de la croissance de l’embryon (par exemple, les cellules du cerveau, les cellules de la peau ou les cellules sanguines). En revanche, 9 mois plus tard à la naissance d’un bébé, la plupart des cellules composant son corps s’engagent à être un type spécifique de cellule avec des fonctions spécifiques. Alors que les cellules se divisent, la boule de cellules souches embryonnaires se développe progressivement en tous les types et structures cellulaires du bébé à terme. Pour que cela se produise, des milliers de gènes doivent être activés ou désactivés au bon moment et dans les bonnes cellules au fur et à mesure de la croissance d’un embryon. Par exemple, les gènes qui fabriquent la protéine fibreuse de kératine qui donne à notre peau sa force ne sont activés que dans les cellules de la peau et non dans le cerveau en développement et les gènes nécessaires au développement et à l’interconnexion des cellules cérébrales sont activés dans le cerveau mais pas dans la peau.
Pendant le développement, les gènes doivent être activés et désactivés. Les étiquettes épigénétiques aident à cela
Un très grand domaine de recherche concerne aujourd’hui le fonctionnement de tous ces gènes activant et éteignant, et une grande partie de ce processus utilise les étiquettes chimiques épigénétiques, en particulier les étiquettes acétyle et méthyle histone. Pour que ces cellules souches embryonnaires puissent donner naissance à tous les autres types de cellules, leurs interrupteurs épigénétiques sont (presque) complètement réinitialisés par rapport aux cellules adultes. J’ai mis « presque » entre parenthèses comme nous le savons par les gènes imprimés et l’héritage épigénétique transgénérationnel qu’il existe des exceptions.
Epigenetics, Dolly le mouton et ses amis
En février 1997, un mouton appelé Dolly est devenu l’exemple le plus célèbre de son espèce, devenant même brièvement une célébrité de la télévision. La raison de sa renommée est qu’elle a été le premier mammifère à être « créé” par un processus appelé transfert nucléaire de cellules somatiques, ou en d’autres termes le premier clone artificiel (fabriqué par l’homme pour être distinct des jumeaux identiques, qui sont des clones naturels). Le processus menant à sa naissance nécessitait un ovocyte mature (un œuf non fécondé) d’une brebis femelle et une cellule ordinaire du pis d’une seconde brebis. Tout d’abord, le noyau (la partie contenant l’ADN) a été retiré de l’ovocyte. Cela a été fait à l’aide d’un microscope spécial car bien que les ovocytes soient assez gros par rapport aux autres cellules, ils sont encore trop petits pour être vus à l’œil nu. Ensuite, le noyau de la cellule du pis a été inséré dans l’ovocyte énucléé. Ainsi, Dolly avait trois « mères »: la donneuse de l’ovocyte, la donneuse de la cellule du pis et la brebis qui portait l’embryon en développement à terme. Aucun père n’était impliqué. Bien que ce processus ait été et reste très inefficace, il a été la première preuve que les gènes d’une cellule de mammifère adulte peuvent être « reprogrammés épigénétiquement” à l’état des cellules souches embryonnaires qui peuvent se développer dans n’importe quel autre type de cellule. Par la suite, le même procédé a été appliqué à d’autres espèces et peut avoir des utilisations médicales pour générer des cellules qui pourraient réparer les tissus endommagés par des blessures ou des maladies.
Résumé: l’épigénome et le projet ENCODE – le « Grand Collisionneur de hadrons” de biologie
Alors que le terme « génome” désigne l’ensemble de la séquence d’ADN d’un organisme (trois milliards de lettres pour l’homme), l’épigénome désigne l’ensemble des modifications épigénétiques de tous les gènes, y compris les étiquettes d’ADN méthylique, les étiquettes d’histone méthylique, les étiquettes d’histone acétylique et d’autres étiquettes chimiques que nous n’avons pas mentionnées, dans chaque type cellulaire d’un organisme. Cela représente une quantité presque inimaginable d’informations, éclipsant même le projet du génome humain. Néanmoins, la connaissance de l’épigénome est essentielle pour répondre pleinement à certaines des plus grandes questions de biologie telles que: comment se développe-t-on d’une boule de cellules identiques en un organisme entier? pourquoi vieillissons-nous? et comment mieux comprendre des maladies telles que le cancer? Il n’est donc pas surprenant que l’épigénétique et l’épigénome constituent un vaste domaine de recherche. Une partie de la recherche dans ce domaine est englobée par le projet ENCODE (Encyclopedia of DNA Elements), une entreprise en cours visant à identifier des modèles d’étiquettes épigénétiques dans de nombreux types de cellules pour l’ensemble du génome humain (http://genome.ucsc.edu/ENCODE/). Le projet ENCODE est parfois comparé au Grand Collisionneur de Hadrons ou LHC en Suisse. Le LHC est le plus grand équipement scientifique jamais construit et les expériences que le physicien mène avec lui visent à sonder les détails fondamentaux de la matière qui compose notre Univers. Bien que les biologistes n’aient pas (ou n’aient pas besoin) d’un kit aussi spectaculaire pour leurs recherches, l’effort d’examiner la complexité de l’épigénome humain a été comparé au projet LHC en raison de son ampleur, de sa complexité et de la quantité d’informations créées.
Erreurs épigénétiques
L’épigénétique est un domaine où nos connaissances scientifiques augmentent rapidement. Une chose que les scientifiques ont découverte est que les erreurs épigénétiques sont courantes dans des maladies telles que le cancer et dans les cellules vieillissantes. En conséquence, les scientifiques développent des médicaments qui ciblent les épigénomes défectueux et l’un des premiers exemples est l’utilisation d’inhibiteurs de l’HDAC, similaires au composé présent dans la gelée royale. De l’étude d’étranges modèles d’héritage tels que l’empreinte génétique, la souris Avy jaune / agouti, la population de chats en écaille de tortue entièrement femelle et d’autres phénomènes connexes, les biologistes ont découvert une toute nouvelle couche d’informations qui se trouve « au-dessus” de la séquence d’ADN de nos gènes. Ces nouvelles découvertes expliquent ces précédentes observations déroutantes, mais ont également un grand potentiel pour de nouvelles connaissances et de nouveaux traitements pour les maladies humaines.
Pour en savoir plus :
- Bird, Adrian. ’Épigénétique. Instant Expert n° 29’, New Scientist, 5 janvier 2013, n° 2898.
- Carey, Nessa. » The Epigenetics Revolution: How Modern Biology is Rewriting Our Understanding of Genetics, Disease and Inheritance « . Éditeur: Icon Books. Broché 1er mars 2012. ISBN-10:1848313470. Prix RRP £ 9-99.
Influences épigénétiques et maladies sur le site Web:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply